Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [9]
Quelle que soit la voie d’exposition, l’épichlorhydrine est rapidement absorbée puis métabolisée, avant d’être éliminée dans l’air exhalé ou sous forme de dérivés mercapturiques urinaires.
Chez l'animal
Absorption
Que ce soit par inhalation ou par voie orale chez le rat, l’épichlorhydrine est rapidement absorbée puis distribuée (plus de 90 % de la dose initiale). Même si l’absorption cutanée n’a pas été quantifiée, celle-ci est confirmée d’une part, par la mort de souris dont la queue a été trempée dans l’épichlorhydrine pendant 15 à 60 min, et d’autre part par la mort de rats, suite à son application sur la peau pendant 1 heure [10].
Distribution
L’épichlorhydrine est ensuite distribuée dans l’organisme des rats en 2 à 4 heures. Après son application sur la peau, les concentrations les plus importantes sont retrouvées dans les reins, l’intestin, le foie, les glandes lacrymales, le pancréas et la rate (épichlorhydrine marquée au 14C). Suite à son inhalation, les niveaux de radioactivité les plus élevés sont mesurés dans la muqueuse nasale [11] ; par voie orale, les niveaux les plus importants sont détectés dans l’estomac, le foie et les reins [12].
Métabolisme
Chez le rat, l’épichlorhydrine est rapidement métabolisée selon 2 voies (Figure 1.) :
- formation de 3-chloro-1,2-propanediol par hydrolyse spontanée ou catalysée par l’hydrolase époxyde,
- après conjugaison avec le glutathion, métabolisation au niveau d’un des deux sites réactifs de la molécule conduisant à la formation de dérivés de l’acide mercapturique : N-acétyl-S-(3-chloro-2-hydroxypropyl)-L-cystéine, S-(2,3-dihydroxypropyl)-L-cystéine et N-acétyl-S-(2,3-dihydroxypropyl)-L-cystéine [9].
Chez le rat, après administration par voie orale, les principaux métabolites sont la N-acétyl-S-(3-chloro-2-hydroxypropyl)-L-cystéine (36 % de la dose) et le 3-chloro-1,2-propanediol (α-Chlorhydrine, 4 % de la dose) [12].
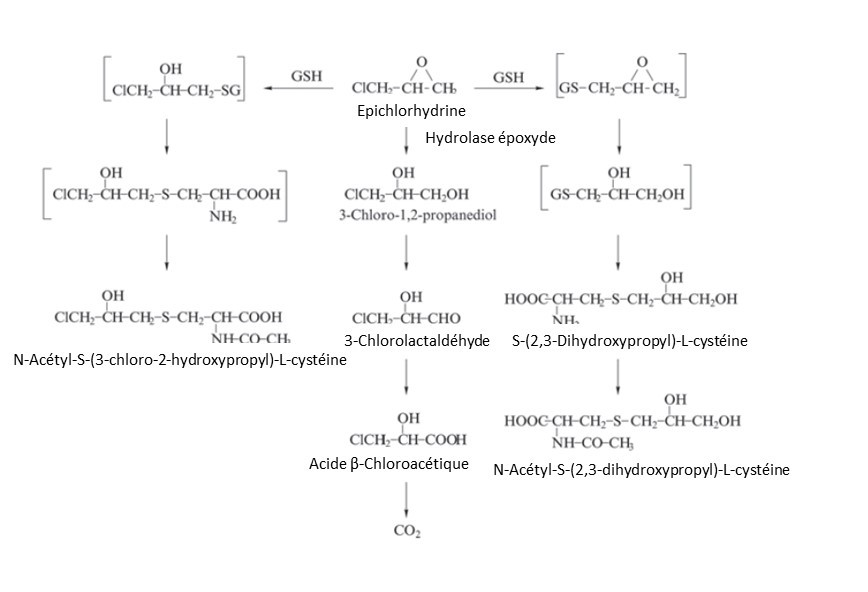
Figure 1. Métabolisme de l’épichlorhydrine chez les rongeurs
Excrétion
À différentes doses et avec différents types d'administration d'épichlorhydrine marquée au 14C, 90 % de la radioactivité a été excrétée en 72 heures : 46 à 54 % dans les urines (métabolites dérivés de l’acide mercapturique), 25 à 40 % par les poumons (CO2) et au maximum 4 % dans les fèces [12].
La demi-vie d’élimination dans l’urine et l’air exhalé est d’environ 2 heures.
Chez l'Homme
Aucune donnée n’est disponible chez l’Homme mais la détection d’adduits à l’hémoglobine et à l’ADN confirme son absorption par inhalation ou par voie orale ; le principal adduit à l’hémoglobine identifié est le N-(3-chloro-2-hydroxypropyl)valine [13].
Surveillance Biologique de l'exposition
Les adduits à l’hémoglobine N-(3-chloro-2-hydroxypropyl)valine et N-(2,3-dihydroxypropyl)valine dans le sang ont été proposés comme indicateurs biologiques d’exposition à l’épichlorhydrine mais peu de données sont disponibles [14, 15].
-
Mode d'actions
-
Toxicité expérimentale
Toxicité expérimentale
Toxicité aiguë [9]
L'épichlorhydrine provoque une hémolyse et une atteinte rénale aiguë. Il s’agit d’un irritant pour la peau, l’œil et les voies respiratoires.
La DL50 par voie orale chez le rat est de 220 mg/kg pc. La DL50 par voie cutanée chez le lapin est comprise entre 515 et 1528 mg/kg pc. La CL50 est de 1920 mg/m3 chez le rat pour une exposition de 4 heures.
Chez le lapin, une hémolyse est constatée. Une atteinte rénale aiguë est possible ; elle se traduit par une anurie ou une oligurie, une néphrose tubulaire à l’examen histologique et une diminution de l’activité de certaines enzymes.
Irritation, sensibilisation
L'épichlorhydrine non diluée entraine une irritation sévère, voire une nécrose de la peau des lapins, 2 à 24 heures après l’exposition [9]. Une irritation marquée est observée suite à l’application d’une solution à 5 % pendant 24 heures sous pansement occlusif, les solutions inférieures à 0,3 % étant sans effet [16].
De la même manière, les solutions inférieures à 10 % sont légèrement irritantes pour les yeux de lapins, alors que les solutions à 80 % entrainent une irritation sévère et des dommages de la cornée [16].
Concernant l’irritation respiratoire de l’épichlorhydrine, une RD50 de 1342 ppm a été déterminée chez le rat [10].
Concernant la sensibilisation cutanée, un test de maximisation donne un résultat positif chez 9 des 15 cobayes testés [17].
Toxicité subchronique, chronique
L’exposition répétée par voie orale entraine une atteinte hématologique chez le rat. Par inhalation, les principaux organes cibles sont les voies respiratoires et les reins.
Dans une étude sur le rat (injections ip, 11-22-56 mg/kg pc, 3 fois /semaine, 12 semaines), des modifications dose-dépendantes de certains paramètres hématologiques ont été notées comme une diminution du taux de l’hémoglobine, une réduction de la proportion de lymphocytes et une augmentation du nombre de leucocytes. Une augmentation du poids du cœur, des reins et du foie a aussi été rapportée aux deux plus fortes doses testées [16].
Des effets similaires ont aussi été observés chez des rats exposés par gavage (3-7-19-46 mg/kg pc/j, 10 jours ou 1-5-25 mg/kg pc/j, 90 jours). Chez les mâles, les niveaux d’érythrocytes, d’hémoglobine et d’hématocrite ont été diminués à 25 et 46 mg/kg pc/j ; à ces doses, le poids de plusieurs organes, dont les reins et le foie, a été augmenté chez les deux sexes. Les observations histopathologiques ont par ailleurs révélé une augmentation dose-dépendante des acanthoses et hyperkératoses de la muqueuse du pré-estomac chez les mâles et femelles [18].
Suite au gavage de rats avec 0-3,3-10 et 30 mg/kg pc/j (10 semaines avant et pendant la période d’accouplement pour les mâles, 2 semaines avant l’accouplement et jusqu’au 21ème jour de lactation pour les femelles), l’observation de signes cliniques, en lien avec le traitement, a été rapportée : à la plus forte dose, les animaux ont présenté des écoulements nasaux, une diminution de leur activité ou une piloérection transitoire. À cette même dose, les poids des reins, du foie, du cœur et des épididymes ont augmenté chez les mâles ; chez les femelles, cette hausse n’a concerné que les reins et le cœur. Des atteintes histopathologiques rénales, telles qu’une nécrose, une dégénérescence ou une vacuolisation dans les cellules tubulaires, ont été observées chez les mâles traités à 30 mg/kg pc/j [19].
Des rats et des souris ont été exposés par inhalation à 0-20-100 et 200 mg/m3 d’épichlorhydrine (6 h/j, 5 j/sem, pendant 90 jours) [20 cité dans le SCOEL [21]]. Chez la souris, des réactions inflammatoires observées dans les régions trachéobronchiolaire et pulmonaire, qui pourraient être liées au traitement, ont été observées chez quelques animaux des groupes exposés à de fortes concentrations. Chez le rat, une inflammation au niveau de la région pulmonaire a été observée aussi bien chez la plupart des témoins que chez les rats exposés, rendant difficile l’interprétation de ces résultats [22]. Les principaux effets ont été rapportés au niveau du nez. À partir de 100 mg/m3, des changements inflammatoires et dégénératifs ont été observés dans les cornets nasaux, notamment une rhinite, des érosions focales, une hyperplasie et une métaplasie avec un aspect squameux (mâles et femelles des deux espèces). Une augmentation du poids relatif des reins, associée à des lésions dégénératives tubulaires modérées à sévères, ont été observées chez les rats exposés à 200 mg/m3.
L’exposition 6 h/j pendant 30 jours de rats à des concentrations de 384 mg/m3 a entraîné une inflammation, une suppuration et la destruction des cornets nasaux, en plus de l'inflammation du larynx et de la trachée. Les troubles pulmonaires étaient principalement un œdème, une congestion et une pneumonie. Aux concentrations de 38 et 115 mg/m3, une augmentation des effets pulmonaires a été rapportée : congestion, pneumonie et bronchiolectasie. Des atteintes rénales ont aussi été observées pour 14 – 37 et 65 % des animaux, respectivement pour les concentrations de 38-115 et 384 mg/m3 : leur sévérité était similaire aux deux concentrations les plus élevées, avec notamment des lésions dégénératives tubulaires, la présence de gouttelettes hyalines, une atrophie rénale, une vacuolisation graisseuse, et occasionnellement, une atrophie des glomérules [23].
Effets génotoxiques [24]
De nombreux tests bactériens et cellulaires ont donné des résultats positifs.
- In vitro
Des résultats positifs ont été obtenus dans de nombreux tests bactériens et cellulaires, avec et sans activation métabolique : l’épichlorhydrine (qui a une action alkylante directe) cause des lésions de l’ADN, des mutations géniques et chromosomiques, des recombinaisons, des cassures simple brin et des échanges de chromatides sœurs.
- In vivo
Des adduits à l’ADN ont été détectés chez le rat et la souris, dans plusieurs organes dont le foie, les poumons, les reins. Suite à des injections intra-péritonéales d’épichlorhydrine radiomarquée, le principal adduit identifié était le N7-(3-chloro-2-hydroxypropyl)guanine [25]. Il a aussi été identifié dans des lymphocytes de travailleurs exposés à l’épichlorhydrine [26].
Des tests de génotoxicité réalisés chez la souris donnent des résultats :
- soit positifs : aberrations chromosomiques (cellules de moelle osseuse, 1 injection ip, 1 mg/kg pc), échanges de chromatides sœurs (cellules de moelle osseuse, 1 injection ip, 6 mg/kg pc) ;
- soit négatifs : aberrations chromosomiques (cellules de moelle osseuse, voie orale, 1 dose de 200 mg/kg pc), micronoyaux (2 injections ip de 100 à 200 mg/kg pc), mutations létales dominantes (1 injection ip de 20 ou de 150 mg/kg pc ; voie orale, dose unique de 40 mg/kg pc ou 5 doses de 20 mg/kg pc).
Effets cancérogènes [24]
Différents types de tumeurs ont été mis en évidence chez la souris et le rat, au niveau du site de contact.
Il a été possible d’obtenir des tumeurs locales chez le rat et la souris par différentes voies d’administration, à des niveaux d’exposition généralement élevés.
L'épichlorhydrine a été administrée chez le rat par voie orale, provoquant des papillomes et des carcinomes du préestomac, et par inhalation, provoquant des papillomes et des carcinomes de la cavité nasale. Elle a également été testée chez la souris : des sarcomes locaux ont été obtenus après injection sous-cutanée et des tumeurs pulmonaires par injection intrapéritonéale.
Des résultats négatifs ont été rapportés suite à une application en continue sur la peau de souris ; toutefois, une étude d’initiation-promotion a mis en évidence le rôle d’initiation de l'épichlorhydrine sur la peau, lors d’une exposition à un agent promoteur (le phorbol 12-myristate 13-acetate) [27].
Effets sur la reproduction
L’épichlorhydrine entraine une diminution de la fertilité masculine ; le peu d'études disponibles concernant les effets sur le développement ou le comportement des nouveau-nés ne met en évidence aucun effet.
Fertilité
Des rats et des lapins mâles ont inhalé 0,5-25 ou 50 ppm d'épichlorhydrine pendant 10 semaines (6 h/j, 5 j/sem) avant d’être accouplés avec des femelles non exposées. À 50 ppm chez le rat, le nombre de femelles fécondées a diminué, malgré un taux d’accouplement constant ; à 25 ppm, une baisse du nombre d’implantations a été rapportée. Aucun effet sur la fertilité n’a été observé chez le lapin [28].
Des injections intra-péritonéales de 3 ou 6 mg/kg pc/j d’épichlorhydrine, pendant 4 jours chez des rats mâles, ont entrainé une diminution du nombre de corps jaunes et du nombre d’implantations chez les femelles non traitées inséminées [29].
Par voie orale, des rats mâles ont reçu 0-12,5-25 et 50 mg/kg pc/j d’épichlorhydrine, pendant 21 jours, avant d’être accouplés avec des femelles non traitées. Aucun effet n’a été observé sur l’accouplement, sur le nombre de spermatozoïdes dans le sperme, sur leur motilité ou sur leur morphologie. À la plus forte dose, malgré les accouplements confirmés, aucune femelle n’a été gestante. Les analyses histopathologiques ont mis en évidence une baisse du nombre de spermatozoïdes dans la queue de l’épididyme, ainsi qu’une diminution de leur vigueur ou de leur capacité à nager [30]. L’absence de fécondation des ovules serait due à une atteinte du métabolisme énergétique des spermatozoïdes au niveau de l’épididyme, causée par le métabolite 3-chloro-1,2-propanediol [31].
Des études menées avec ce métabolite ont confirmé sa responsabilité dans l’incapacité des spermatozoïdes à féconder les ovules, notamment en diminuant les niveaux d’ATP dans les spermatozoïdes ce qui entrave leur motilité, et baisse leur capacité à pénétrer dans les ovules [32, 33].
Dans une étude récente de reprotoxicité sur une génération, des rats ont été gavés avec 0-3,3-10 ou 30 mg/kg pc/j, soit 10 semaines avant et pendant la période d’accouplement pour les mâles, soit 2 semaines avant l’accouplement et jusqu’au 21e jour de lactation pour les femelles. Aux 2 plus fortes doses, la quasi-totalité des mâles était dans l’incapacité de féconder les femelles : le nombre de femelles gestantes, de corps jaunes et d’implantations était nul. La baisse de la fertilité masculine et du taux de gestation des femelles était déjà observée à 3,3 mg/kg pc/j, mais non statistiquement significative [19].
Développement
Aucune toxicité prénatale n’a été mise en évidence chez des rats et des lapins exposés par inhalation à 2,5 et 25 ppm [34]. Par voie orale, aucun effet tératogène n’a été rapporté chez des rats et des souris exposés à des doses toxiques pour les mères et entraînant une diminution du poids fœtal (jusqu’à 160 mg/kg pc/j) 35].
Aucun effet sur le développement des nouveau-nés ou sur leur comportement n'a été rapporté dans l’étude sur une génération [19].
-
Toxicité sur l’Homme
L’exposition, aussi bien aiguë que chronique, à l’épichlorhydrine est à l’origine d’une irritation des muqueuses respiratoire et oculaire. L’intoxication aiguë par inhalation se traduit par des symptômes digestifs, neurologiques et respiratoires, pouvant se compliquer d’œdème pulmonaire lésionnel. Le contact direct est à l’origine de brûlures d’apparition retardée et de lésions oculaires graves. Une sensibilisation cutanée est possible. Un effet génotoxique a été observé chez les travailleurs exposés.
Toxicité aiguë [36-39, 19]
Les vapeurs et aérosols d’épichlorhydrine ont un effet irritant important, voire corrosif, pour les muqueuses respiratoire et oculaire et pour la peau. La présentation clinique et la gravité des symptômes sont fonction de la concentration et du temps d’exposition, associant diversement une sensation d’irritation des yeux, du nez et de la gorge, des éternuements et épistaxis, ainsi que des troubles respiratoires pouvant se compliquer d’un œdème pulmonaire lésionnel. L’exposition à de fortes concentrations s’accompagne de symptômes neurologiques et digestifs (céphalées, respiration laborieuse, nausées, vomissements, tremblements).
Des cas isolés de séquelles respiratoires (Syndrome de Brooks, trouble ventilatoire obstructif avec augmentation des infections des voies aériennes supérieures) et hépatiques (troubles fonctionnels et infiltration graisseuse du foie) ont été rapportés.
Le contact direct peut être à l’origine de graves brûlures chimiques cutanées, survenant souvent après un certain délai, ainsi que des lésions oculaires irréversibles. Un érythème polymorphe a été rapporté chez un travailleur préalablement sensibilisé à l’épichlorhydrine [40].
L’ingestion provoque des brûlures du tractus digestif, céphalées, vomissements et diarrhée, pouvant se compliquer d’un coma.
Toxicité chronique [38]
L’exposition chronique à l’épichlorhydrine a été associée à la prévalence de symptômes d’irritation des voies respiratoires [41, 38] et à des anomalies de certains paramètres de la fonction respiratoire (Débit Expiratoire Maximal Médian), pour des expositions moyennes de 1,1 ppm [intervalle : 0.2–5.9 ppm] [41]. Le rôle des polymorphismes génétiques est avancé (paramètres ventilatoires plus mauvais en l’absence de GSTM1) [42].
Le contact prolongé ou répété peut provoquer une sensibilisation cutanée, mais les dermatites de contact allergique sont moins fréquentes que les irritatives [43].
Au niveau oculaire, l’exposition répétée peut entrainer une inflammation chronique avec sténose ou obstruction du canal lacrymal, accompagnée de symptômes d’irritation, traduisant une kératite [44].
Un excès de décès par maladie cardiovasculaire chez des travailleurs exposés à l’épichlorhydrine dans les années 40-60 avait été suspecté, mais le taux restait similaire à celui de la population générale et les études postérieures n’ont pas montré d’association.
Effets génotoxiques
Des études de cytogénétique menées dans les années 70-90 chez des travailleurs exposés à l’épichlorhydrine ont mis en évidence un effet génotoxique de celle-ci, notamment une augmentation des aberrations chromosomiques, mais aussi chromatiniennes et de la fréquence de cellules aberrantes par rapport aux groupes contrôle [45 à 51].
Effets cancérogènes [24, 51, 21]
Quatre cohortes de travailleurs exposés à l’épichlorhydrine dans les années 40-90 ont fait l’objet d’études épidémiologiques. Un excès de risque de décès par cancer du poumon a été initialement retrouvé chez un petit nombre de travailleurs employés dans la production d’épichlorhydrine, mais l’étude cas-témoins nichée n’a pas retrouvé d’association avec le niveau ou la durée d’exposition. Un léger excès de cancer du poumon a été observé dans une autre cohorte, mais dans une troisième aucun excès n’a été observé. Enfin, une étude cas-témoins nichée dans une cohorte de travailleurs de la chimie a mis en évidence une diminution significative du risque de cancer du poumon.
Un excès de décès par mélanome, cancer de la prostate et leucémie a aussi été observé dans une des cohortes, chez les travailleurs exposés depuis plus de 20 ans, sans qu’aucune relation avec les niveaux d’exposition n’ait pu être mise en évidence ; ces risques n’ont pas été confirmés. Un excès de risque non significatif de cancers du système nerveux central a aussi été noté.
Au total, les données disponibles, basées sur un petit nombre de cas et sans contrôle précis des possibles facteurs de confusion, ne permettent pas une évaluation adéquate du risque cancérogène de l’épichlorhydrine chez l’Homme.
Effets sur la reproduction
Une possible toxicité testiculaire de l’épichlorhydrine a été discutée mais non retrouvée dans des études anciennes [52, 53, 54]. Néanmoins, les données disponibles sont insuffisantes pour conclure définitivement sur l’absence d’association entre une exposition à l’épichlorhydrine et des anomalies du spermogramme.
Aucune autre étude chez des travailleurs exposés à l’épichlorhydrine sur les éventuels effets sur la fertilité féminine, la grossesse, le développement pré- et postnatal n’a été identifiée à la date de publication de cette fiche.
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
