Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [14, 15]
Les oxydes d’azote sont absorbés principalement par voie respiratoire. Le monoxyde d’azote se fixe dans le sang à l'hémoglobine pour former de la nitrosylhémoglobine, puis de la méthémoglobine, avant une élimination principalement par les reins sous forme de nitrates. Le peroxyde d’azote et le tétraoxyde d’azote ne sont pas à l’origine de nitrosylhémoglobine.
Chez l'animal
Absorption
Les oxydes d'azote pénètrent dans l'organisme essentiellement par inhalation mais les passages percutanés sont possibles. L’absorption pulmonaire du peroxyde d’azote est de 50 à 60 % chez le singe [16] ; concernant le monoxyde d’azote, le taux d’absorption varie de 20 à 90 % selon l'espèce, la fréquence respiratoire et le mode de respiration (nasal ou oral). L’absorption du tétraoxyde d’azote est supposée similaire à celle du dioxyde d’azote [17].
Les oxydes d'azote pénètrent dans l'organisme essentiellement par inhalation, mais les passages transcutané et au cours de contacts oculaires sont possibles. Le monoxyde d'azote, peu soluble dans l'eau, pénètre dans la circulation sanguine au niveau des alvéoles alors que le peroxyde d'azote, plus soluble, est absorbé à tous les niveaux du tractus respiratoire. Chez l'homme (0,613,6 mg/m3) l'absorption de peroxyde d'azote est de 81-90 % pendant une respiration normale et 90 % pendant une respiration forcée. Elle est de 31 à 50 % chez le singe et varie de 25 à 85 % chez le chien, le lapin et le rat selon l'espèce, la fréquence respiratoire et le mode de respiration.
Le monoxyde d'azote pénètre dans la circulation sous forme non transformée. In vitro, il se lie à l'hémoglobine pour former de la nitrosylhémoglobine qui se transforme en méthémoglobine en présence d'oxygène. In vivo, chez la souris, le taux de nitrosylhémoglobine devient stable après 30 min et décline rapidement après arrêt de l'exposition. Une exposition à 4,5 mg/m3 pendant 23-29 mois induit un taux sanguin de nitrosylhémoglobine constant (0,01 %) et un taux de méthémoglobine maximal de 0,3 % [29].
Après absorption, le peroxyde d'azote est hydrolysé en acide nitrique puis transformé en ions nitrites avant de pénétrer dans la circulation sanguine ; après arrêt de l'exposition, le taux sanguin de ces ions diminue rapidement. Les nitrites réagissent avec l'hémoglobine pour former la nitrosylhémoglobine dont le taux est en relation linéaire avec l'exposition.
Dans le cas des deux oxydes d'azote, les ions nitrites et nitrates rapidement formés à partir de la nitrosylhémoglobine sont transférés dans le sérum. La majeure partie des nitrates est excrétée dans l'urine par les reins. Les nitrates sanguins restants sont excrétés soit dans la cavité buccale par la salive, où ils sont convertis en nitrites par les bactéries, atteignent l'estomac, y sont transformés en azote gazeux et disparaissent, soit dans l'intestin où ils sont transformés par les bactéries intestinales en ammoniac excrété dans les fèces, soit à travers les parois intestinales et excrété dans l'urine après métabolisation en urée. L'excrétion urinaire de 15N] après 48 h chez le rat est de 55% de la dose de [15N]O, dont 75 % de nitrates et 24 % d'urée.
Distribution
Le monoxyde d'azote pénètre dans la circulation sanguine sous forme non transformée. Il se lie à l'hémoglobine pour former de la nitrosylhémoglobine (NOHb) qui se transforme en méthémoglobine (MetHb) en présence d'oxygène ; des ions nitrites et nitrates sont ensuite formés.
Chez la souris, le taux de nitrosylhémoglobine est proportionnel au niveau d’exposition pour des fortes concentrations en monoxyde d’azote et peroxyde d’azote (entre 20 et 80 ppm) ; il n’existe pas de relation pour la MetHb. Chez les souris exposées à 40 ppm de NO, le taux de NOHb devient stable après 30 min (0,7%) et décline ensuite rapidement quand les souris ne sont plus exposées ; un taux de MetHb de 5 % est mesuré dans le même temps et suit la même évolution que la NOHb. L’exposition à 40 ppm de NO2 entraine la formation de très peu de NOHb (0,2 %) et aucune MetHb n’est détectée [18].
Les concentrations sanguines en nitrites et nitrates augmentent pour atteindre un équilibre après 10 et 30 minutes respectivement [19]. Dans les cas du NO et du NO2, les ions nitrites et nitrates rapidement formés à partir de la nitrosylhémoglobine sont expulsés des globules rouges et se retrouvent dans le sérum. A l’arrêt de l’exposition, le taux sanguin de ces ions diminue rapidement.
Suite à l’inhalation de 138-880 ppm de 15NO radiomarqué, de faibles quantités de 15N ont été retrouvées dans les poumons, la trachée, le foie, les reins et les muscles des rats exposés [20].
Chez le singe et le rat, il a été montré que les oxydes d’azotes réagissent avec les fluides et les tissus de l’organisme (notamment au niveau du poumon) et peuvent former des acides nitreux et nitriques puis être dissociés en ions nitrates et nitrites [16].
Excrétion
La majeure partie des nitrates est excrétée dans l'urine par les reins. La faible proportion de nitrates restants peut alors :
- être excrétée dans la cavité buccale par la salive, où les nitrates sont convertis en nitrites par les bactéries ;
- atteindre l'estomac, y être transformée en azote gazeux et disparaitre, soit dans l'intestin où ils sont transformés par les bactéries intestinales en ammoniac excrété dans les fèces, soit à travers les parois intestinales et excrété dans l'urine après métabolisation en urée (cf figure 1).
L'excrétion urinaire de 15N après 48 h chez le rat est de 55 % de la dose de 15NO, dont 75 % de nitrates et 24 % d'urée [14].
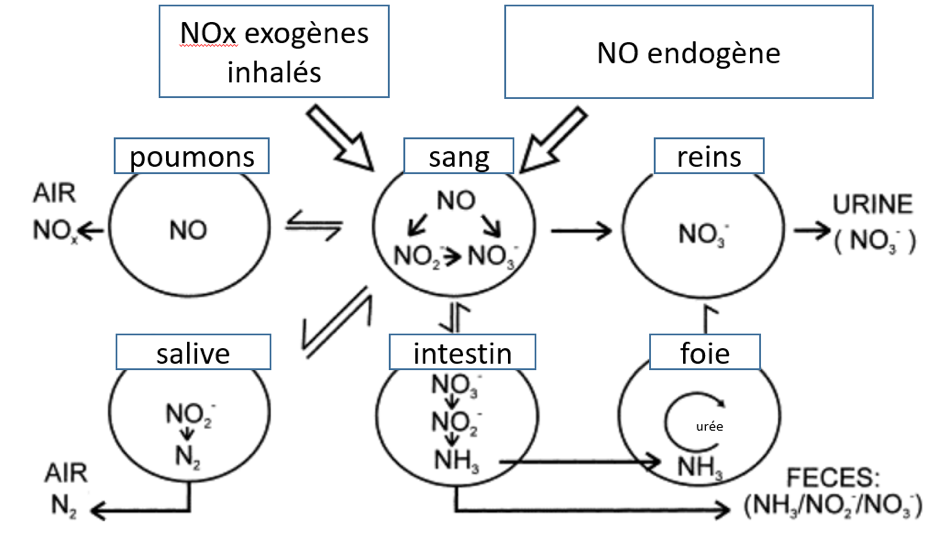
Figure 1. Biotransformation des oxydes d’azote chez les mammifères [21].
-
Mode d'actions [14, 22]
Le mécanisme exact de la toxicité pulmonaire du peroxyde d'azote n'est pas entièrement élucidé. Cependant, l'hypothèse d'un effet direct par oxydation des lipides et des protéines a été postulée [23] ; l'inflammation pulmonaire est en effet diminuée après ingestion d'antioxydants (vitamines C et E) [15].
En raison d'éventuelles réactions de nitrosation, on peut envisager, en présence d'amines et dans certaines conditions, la possibilité de la formation de nitrosamines. Certaines nitrosamines sont inactives mais la majorité d'entre elles peut donner, après transformation, des métabolites alkylants susceptibles d'effets génotoxiques, tératogènes ou cancérogènes.
-
Toxicité expérimentale
Toxicité aiguë [24, 25]
Les oxydes d'azote sont des irritants respiratoires puissants qui peuvent provoquer de graves lésions pulmonaires. Ils induisent une vaso- et une bronchodilatation.
La CL50 du monoxyde d'azote est de 141 mg/m3/h chez le rat (115 ppm). L'inhalation induit une vasodilatation artérielle pulmonaire, une bronchodilatation (à partir de 5 ppm), un œdème pulmonaire à forte dose responsable de la létalité ainsi que la formation réversible de méthémoglobine [25]. Les fortes doses peuvent aussi avoir des effets sur le système nerveux central [17].
La CL50 par inhalation du peroxyde d'azote est de 169 mg/m3/4 h chez le rat, 56 mg/m3/h chez le cobaye, 590 mg/m3/15 min chez le lapin et 1880 mg/m3/10 min chez la souris. L'inhalation entraîne une modification dose-dépendante de la fonction respiratoire (baisse du volume courant et augmentation de la fréquence respiratoire), une augmentation du poids relatif des poumons avec diminution de la compliance et œdème. La lésion pulmonaire est caractérisée dans les premières 24 heures par une destruction, au niveau des bronchioles, des cellules ciliées et de l'épithélium, une dégénérescence des cellules épithéliales alvéolaires de type I et un dépôt de fibrine ; cette réponse est suivie d'une phase de réparation atteignant un maximum en 48-72 heures (hyperplasie des cellules épithéliales alvéolaires de type II, remplacement des cellules ciliées par des cellules de Clara, infiltration de cellules inflammatoires) avec apparition d'un œdème interstitiel et alvéolaire [23, 26, 27]. L'importance de la lésion est accrue par l'augmentation du débit ventilatoire pendant l'exposition ou par l'exercice après l'exposition [26]. Les animaux jeunes ont une réponse hyperplasique plus importante que les plus âgés ; ceux-ci ont un temps de réparation plus long qui entraine l'apparition d'un œdème pulmonaire mortel avant que se développe l'hyperplasie [28]. Des modifications hématologiques sont aussi observées (hypoxémie, méthémoglobinémie légère et augmentation de la fragilité osmotique des érythrocytes chez le singe).
Une synergie a été décrite lors d'une exposition concomitante à l'ozone [29].
Une hyperréactivité bronchique chez le cobaye [25, 30] et une modification des mécanismes de défense antibactérienne au niveau pulmonaire chez la souris[31, 32]ont été décrites après inhalation d'oxydes d'azote.
En exposition subaiguë, la bronchiolite et la pneumonie sont létales ; certains effets tendent à devenir progressivement permanents (prolifération fibroblastique, bronchiolite fibrosante puis oblitérante) tandis que d'autres restent réversibles (hyperplasie cellulaire)[28].
Il est également rapporté une immunodépression transitoire chez le rat exposé au peroxyde d’azote à 26 ppm (50 mg/m3) pendant 24 heures [33], une atteinte des cellules spléniques et thymiques chez la souris exposée à des concentrations de 20 - 40 ppm (38 - 76 mg/m3) pendant 12 heures [34].
- Irritation
Les oxydes d'azote sont des irritants puissants des muqueuses, leur principale cible est l'appareil respiratoire et en particulier le parenchyme pulmonaire.
Le monoxyde d'azote sous forme de gaz est corrosif pour les yeux et les voies respiratoires et irritant pour la peau. La gravité des symptômes peut varier selon les conditions d'exposition (concentration du produit, durée du contact, etc.) [35]. Il se convertit naturellement en peroxyde d’azote.
Le peroxyde d’azote et le tétraoxyde de diazote sont des irritants oculaires (concentrations > 10 ppm) ; une exposition prolongée à une forte concentration de 70 ppm pendant 8 heures, entraine l’apparition d’un voile persistant sur la cornée de lapins [17]. Les effets irritants sur le tractus respiratoire apparaissent dès 1-13 ppm et dépendent de la concentration. Le contact direct avec du tétraoxyde de diazote liquide est, de plus, corrosif pour la peau.
- Sensibilisation
Le peroxyde d’azote augmente le risque de sensibilisation aux allergènes en suspension dans l’air. Un certain nombre d'études ont analysé l'effet du NO2 sur les réactions allergiques de type asthme en utilisant des modèles animaux sensibilisés à différents antigènes. À de faibles concentrations de NO2 (< 1 ppm), les indicateurs de l'asthme allergique avec les modèles animaux sensibilisés à l'antigène étaient négatifs [36]. Cependant, des augmentations du taux d’immunoglobulines E (IgE) sériques, d’IgA, IgG et IgE au niveau local ainsi qu’une augmentation de cellules inflammatoires au niveau pulmonaire ont été observées chez des modèles de rats Brown Norway, sensibilisés aux acariens, dès la concentration de 5 ppm de NO2 37.
Alors que l’exposition à 5 ppm de NO2 6 h/j pendant 3 jours n'a provoqué aucun changement pathologique chez des souris sensibilisées à l’ovalbumine, l’exposition à 25 ppm de NO2 a induit une réponse inflammatoire, avec une augmentation des éosinophiles et des lésions au niveau des bronchioles terminales 38.
Ainsi, des expositions de courte durée au peroxyde d’azote peuvent exacerber les symptômes liés à l’asthme. Les mécanismes doivent être élucidés mais il est fort probable que le stress oxydatif et une dérégulation du système immunitaire soient en cause 39, 40.
Toxicité subchronique, chronique [41-43]
L'inhalation répétée peut provoquer des lésions de l'épithélium bronchique et alvéolaire. Une atteinte hépatique est décrite chez certaines espèces.
Lors d'expositions chroniques au peroxyde d'azote, le taux d'hémoglobine, l'hématocrite et la numération leucocytaire ne sont pas modifiés chez le chien. Chez le lapin, on observe une baisse du nombre d'érythrocytes et une augmentation des leucocytes et chez le rat une polyglobulie ainsi que des altérations de la membrane érythrocytaire [44].
Chez le rat, des concentrations de peroxyde d'azote supérieures à 1,5 mg/m3 (0,5 ppm) pendant 7 mois induisent des modifications ultrastructurales au niveau des bronchioles (perte de cils, vacuolisation, inclusions cristalloïdes intracytoplasmiques, hypertrophie de l'épithélium entraînant une obstruction des bronchioles terminales) et une atteinte alvéolaire (remplacement progressif des pneumocytes de type I par des pneumocytes de type II) qui favorise l'extravasation de liquide et perturbe les échanges gazeux. Le développement d'un emphysème est observé chez la souris (0,5 ppm, 90 j à 360 j), le lapin (1025 ppm, 140 j) et le chien beagle (25 ppm, 180 j). Pour obtenir des modifications pulmonaires identiques, les concentrations de monoxyde d'azote nécessaires sont cinq fois plus importantes [18].
Une exposition prolongée à de faibles concentrations de peroxyde d'azote (0,9-6,6 mg/m3, 0,5-3,5 ppm) peut prédisposer les animaux aux infections respiratoires par suite de la perturbation des mécanismes de défense (clairance mucociliaire, viabilité et activité phagocytaire des macrophages, suppression de fonctions immunologiques humorales et cellulaires) [44].
Un effet hépatique du peroxyde d'azote a été décrit chez la souris, le rat et le cobaye (augmentation du temps de sommeil induit par le phénobarbital, baisse du taux de cytochrome P450 hépatique, des protéines et lipoprotéines sériques et de la cholinestérase plasmatique). Il modifie également les mécanismes de défense antioxydants, induit la peroxydation des lipides et la synthèse du collagène et perturbe certaines activités enzymatiques [44].
Les effets chroniques du tétraoxyde de diazote sont similaires à ceux du peroxyde d’azote [17].
Effets génotoxiques [45, 46]
Le monoxyde d'azote est mutagène in vitro. Le peroxyde d'azote est mutagène et clastogène in vitro et induit des mutations et lésions chromatidiennes in vivo.
In vitro
L'effet génotoxique des oxydes d'azote a été étudié par balayage ou barbotage du gaz dans le milieu de culture.
Le monoxyde d'azote est mutagène pour les souches TA100 et TA1535 de Salmonella typhimurium (l'effet est potentialisé par une exposition simultanée au peroxyde d'azote et diminué par les antioxydants) et pour les fibroblastes de hamster chinois (cellules Don) ; aucun effet sur la réparation de l'ADN n'a été observé. Dans les cellules V79 de hamster chinois, il n'a pas d'influence sur la viabilité et n'induit aucune lésion détectable de l'ADN à des concentrations allant jusqu'à 940 mg/m3 pendant 30 min.
Le peroxyde d'azote est mutagène pour la souche TA100 de Salmonella typhimurium avec ou sans activation métabolique ; les résultats sont négatifs pour les souches TA102 et TA104 et les cellules Don de hamster chinois. Il est un faible inducteur de la réparation SOS et de l'arrêt de la réplication de l'ADN d'Escherichia coli WP2. Dans les cellules V79 de hamster chinois, le peroxyde d'azote est cytotoxique, il augmente les cassures de l'ADN avec une relation dose - temps d'exposition - effet et induit des échanges entre chromatides sœurs (à partir de 9,4 mg/m3) ainsi que des aberrations de type chromatidien (lacunes et fractures à partir de 18,8 mg/m3) et chromosomique (échanges et cassures à une concentration de 188 mg/m3).
In vivo
Le peroxyde d'azote induit des mutations et des aberrations chromatidiennes, dose-dépendantes, dans les cellules pulmonaires de rats exposés à des concentrations allant de 15 à 51 mg/m3/3 h ; dans les mêmes conditions, le monoxyde d'azote n'est mutagène qu'à la plus forte dose. Les autres tests effectués avec le peroxyde d'azote sont négatifs (aberrations chromosomiques dans les lymphocytes et les spermatocytes de souris, micronoyau dans la moelle osseuse de souris).
L’exposition de rats mâles Wistar à 5, 10 et 20 mg/m3 de peroxyde d’azote (2,66 - 5,32 et 10,64 ppm, 6 h/j, pendant 7 jours) induit des cassures de brin d’ADN dans les cellules de divers organes (cerveau, poumon, foie, rate, rein et cœur) et une augmentation de micronoyaux dans les cellules de moelle osseuse. Les effets observés sont dose-dépendants [47].
Effets cancérogènes [45]
Le monoxyde d'azote n'entraîne pas de tumeurs malignes chez la souris et le hamster. Le peroxyde d'azote induit des tumeurs pulmonaires bénignes et il agit également comme promoteur de tumeur.
Le monoxyde d'azote n'augmente pas le taux de leucémies ou d'adénomes pulmonaires chez la souris JcL: ICR (2,4 ppm, toute la durée de la vie).
Il n'y a pas d'augmentation du taux de tumeurs malignes chez la souris NMRI (40 ppm de peroxyde d'azote, 16 mois) ni chez le hamster doré (40 ppm de peroxyde d'azote + 20 ppm de monoxyde d'azote, 16 mois), bien qu'une prolifération cellulaire, une atypie de l'épithélium bronchique et des adénomes pulmonaires aient été observés. Chez la souris A/J, présentant un taux élevé de tumeurs pulmonaires spontanées, le peroxyde d'azote (10 ppm, 6 h/j, 5 j/sem, 6 mois) induit une légère augmentation de la fréquence et de l'incidence des adénomes pulmonaires.
Le peroxyde d'azote peut promouvoir le développement de tumeurs pulmonaires (rat, 4 ppm pendant 17 mois, induction par une injection i.p. de bis(2-hydroxypropyl)nitrosamine) et modifier le développement et la progression des métastases pulmonaires (souris, 0,3-0,8 ppm pendant 12 semaines, puis injection de cellules de mélanome).
Effets sur la reproduction
Des études déjà anciennes portant sur la fertilité après exposition au peroxyde d’azote ne montrent pas d’anomalies au niveau de l’appareil reproducteur mâle ; en revanche, chez les femelles, des dysfonctionnements au niveau du cycle œstral sont rapportés. L'exposition pendant la gestation provoque des anomalies neurocomportementales chez les nouveau-nés.
Fertilité
Aucune étude récente de toxicologie expérimentale ne s’est intéressée aux effets des oxydes d’azote sur la fertilité et notamment sur l’altération de la qualité du sperme. Seule une étude déjà ancienne montre que le peroxyde d’azote n’exerce aucun effet sur la spermatogénèse, les cellules germinales ou les cellules interstitielles des testicules de rats (1ppm soit 1,91 mg/m3, 7 h/j, 5 j/sem pendant 3 semaines) [48].
Une étude sur la reproduction a montré que l’exposition de rats à 0,067 ou 1,3 ppm de NO2 (12 h/j pendant 3 mois) n’a produit aucune variation du nombre de femelles gestantes après accouplement avec des mâles non exposés. À la dose plus élevée, des anomalies dans le cycle œstral des femelles ont été constatées (allongement du cycle, augmentation de la durée du dioestrus, diminution du nombre de follicules) [49].
Développement
Des rats et des souris ont été exposés à des concentrations croissantes de NO2, pendant tout ou partie de la gestation, sans effet sur la viabilité des nouveau-nés (pour le rat, de 0,03 à 5,4 ppm, 6 h/j, durant toute la gestion ; pour la souris, 22 à 45 ppm, du 7ème au 18ème jour de gestation)[46, 50]. En revanche, des déviations neurocomportementales liées à la dose ont été observées (perturbation du développement neuromoteur précoce, déficits de coordination, retard de développement de la locomotion et de l'activité), la réduction de l’activité motrice persistant après le sevrage.
Neurotoxicité
Les études de neurotoxicité menées avec le peroxyde d’azote montrent une augmentation de marqueurs du stress oxydatif ainsi que certaines perturbations neurochimiques.
Peu d’études expérimentales ont évalué la neurotoxicité potentielle du peroxyde d’azote. Une perturbation du métabolisme mitochondrial avec une baisse de la production d’ATP et une augmentation de la production d’espèces réactives de l’oxygène ont été observées au niveau du cortex de rats (5-10 ou 20 mg/m3, 5 h/j, 7 j) [51]. À ces mêmes concentrations, une augmentation de l’apoptose de neurones, une altération de l’activité anti-oxydante et une dérégulation de l’expression de gènes liés à l’apoptose ont été constatées au niveau du cortex de rats exposés, 6 heures/jour pendant 7 jours à du NO2 aux concentrations de 5, 10 et 20 mg/m3 [52].
Lors d’expositions chroniques 2 h/j pendant 35 j de cobayes à 9,4 ou 18,8 mg/m3 (5 ou 10 ppm) de peroxyde d’azote, une diminution des taux de lipides totaux, de cholestérol et de phospholipides dans différentes régions du cerveau a été mesurée [53]. Des modifications légères des concentrations de catécholamines ont été observées après exposition chronique de cobayes mâles à des concentrations de peroxyde d’azote de 0,1 ppm en continu pendant 1, 2, 5 et 6 mois [54]. Ces variations ne sont pas spécifiques des zones cérébrales prélevées (thalamus, hypothalamus, hippocampe et cortex frontal). L’exposition de rats mâles au NO2 à 3,5 ppm pendant 1 ou 2 mois n’a engendré ni modification hormonale ni variation de poids des différents tissus explorés (poumon, surrénales, rate, foie et hypothalamus) mais une baisse de la concentration de noradrénaline a été mesurée dans l’hypothalamus après 2 mois de traitement [55].
-
Toxicité sur l’Homme
Les oxydes d’azote sont des irritants puissants pour les muqueuses oculaires et respiratoires, et peuvent entraîner à fortes doses un œdème pulmonaire potentiellement fatal ou laissant des séquelles. Lors d'expositions répétées à de faibles concentrations, on peut observer une altération de la fonction respiratoire, un emphysème et une sensibilité accrue aux infections respiratoires. Les personnes asthmatiques et/ou atteintes d'une autre maladie respiratoire chronique peuvent être particulièrement sensibles aux effets des oxydes d'azote. On ne dispose pas de données sur d'éventuels effets cancérogènes ou sur la fonction de reproduction.
Toxicité aiguë
Les effets respiratoires des oxydes d’azote dépendent de la concentration des gaz et de la durée de l’exposition. Compte tenu de l'exposition simultanée à du NO et du NO2, ce dernier étant en équilibre constant avec le N2O4, il est souvent difficile de distinguer les effets de chaque espèce moléculaire pure, même si les données semblent en faveur d’une moindre toxicité du NO par rapport au NO2. L'intoxication aiguë est généralement mortelle en quelques instants par arrêt cardio-respiratoire [56].
L'intoxication aiguë aux oxydes d’azote évolue le plus souvent en trois phases [41] :
- Une irritation plus ou moins marquée des voies aériennes supérieures avec bronchospasme, accompagnée de toux, de dyspnée et de nausées, souvent associée à une irritation oculaire avec larmoiement. Cette irritation disparaît rapidement dès la fin de l'exposition et passe même parfois inaperçue.
- Une phase de récupération, plus ou moins asymptomatique qui dure de quelques heures (6 à 24 h) à quelques jours.
- Une détresse respiratoire avec toux, dyspnée, fièvre, en rapport avec un œdème aigu du poumon. Si l'évolution n'est pas fatale, l'épisode aigu peut évoluer vers la guérison totale ou une bronchopneumonie de pronostic le plus souvent favorable. Il peut parfois être suivi par le développement d'une bronchiolite oblitérante fibrosante qui peut entraîner le décès en quelques semaines, si les lésions sont importantes, ou engendrer des séquelles fonctionnelles importantes (fibrose ou emphysème).
Cette évolution chronologique est classiquement observée suite à l’exposition massive et accidentelle au NO2 mélangé à d’autres oxydes d’azote issus de la fermentation des céréales en silo (maladie des ensileurs)[57, 58].
De très nombreuses études expérimentales humaines en atmosphère à concentrations contrôlées de NO2 ont été réalisées (0,1 à 3,5 ppm pendant 30 min à 6 h), afin d'étudier les effets sur la fonction respiratoire, la réponse immunitaire et l’inflammation pulmonaire [59]. Certains auteurs ont constaté une augmentation de la résistance des voies aériennes chez des sujets normaux, bien que les résultats de ces expérimentations soient assez controversés. Les altérations fonctionnelles respiratoires étaient généralement légères et transitoires ; elles n’étaient pas toujours accompagnées de symptômes. À des concentrations de NO2 supérieures à 1 ppm, il existe des données relativement cohérentes en faveur d'une réponse inflammatoire et d'une altération de la fonction des macrophages au niveau pulmonaire chez des sujets sains. Certains sujets souffrant d'affections respiratoires chroniques ou les sujets asthmatiques pourraient être plus sensibles à l'effet du NO2 (hyperréactivité bronchique et effets pro-inflammatoires).
Des brûlures de la peau et des lésions oculaires graves peuvent s’observer en cas de contact cutané ou oculaire avec des concentrations importantes d’un mélange d’oxydes d’azote ou de NO2 liquide [60].
L’analyse des événements indésirables chez les patients traités par NO a mis en en évidence un risque accru d'insuffisance rénale chez les adultes [61]. La survenue d’une méthémoglobinémie est rare dans le cadre de l’usage thérapeutique du NO inhalé [62].
Toxicité chronique [41]
L'intoxication chronique, avec des troubles irritatifs oculaires et respiratoires, est discutée. Il semble que l'exposition prolongée à une concentration insuffisante pour induire un œdème pulmonaire puisse favoriser le développement d'emphysème. Une diminution du VEMS (volume expiratoire maximal par seconde) et de la CVF (capacité vitale forcée) a été observée chez des travailleurs d’une centrale électrique exposés au NO2 (concentrations atmosphériques de 0,6 à 4,1 ppm), par rapport aux travailleurs administratifs non exposés [63]. L’altération de la fonction pulmonaire (notamment par augmentation de la résistance des voies aériennes) rapportée par certains auteurs n’est pas observée dans toutes les études [64].
La diminution de la résistance aux infections pulmonaires, suggérée par certains travaux chez des travailleurs exposés de façon prolongée à des concentrations de NO2 de 0,5 à 3,5 ppm pourrait s'expliquer par des altérations des paramètres immunologiques (notamment les immunoglobulines sériques) observées dans quelques études.
Effets génotoxiques
Aucune donnée n’est disponible chez l’homme à la date de publication de cette fiche toxicologique.
Effets cancérogènes
Les seules données disponibles sont issues des études épidémiologiques en population générale évaluant le risque de cancer du poumon en lien avec le NO2 de la pollution atmosphérique, et ont montré des résultats négatifs, non significatifs, ou des associations faibles [65, 66]. La pollution en milieu urbain ne se limitant pas exclusivement aux oxydes d’azote, il est difficile d’extrapoler le risque évalué à partir des concentrations environnementales de NO2 aux travailleurs exposés en milieu de travail. Les oxydes d'azote n'ont pas été classés du point de vue de la cancérogénicité.
Effets sur la reproduction
Il n’y a pas à ce jour de donnée publiée sur la toxicité du NO ou du N2O4 pour la fertilité ou au cours de la grossesse dans le cadre d’expositions en milieu professionnel. Les études sur les effets de la pollution atmosphérique contenant notamment du NO2 sur la reproduction et le développement montrent des résultats contradictoires. Elles sont par ailleurs limitées par le manque de spécificité des polluants atmosphériques, qui sont nombreux et variés, ainsi que par l’absence de l'évaluation individuelle de l'exposition [67 à 69].
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
