Pathologie - Toxicologie
Le TDI est principalement absorbé par voie respiratoire. A la suite d’une exposition par inhalation, la majorité du TDI forme des adduits avec les macromolécules de l'organisme alors que par voie orale, il est rapidement métabolisé en toluènediamines (TDA) libres ou acétylées. Les 2,4- et 2,6-TDI conjugués aux macromolécules, les TDA et leurs produits acétylés sont excrétés dans les urines et les fèces.
Le TDI est très toxique par inhalation. Il entraîne des irritations respiratoires, cutanées et oculaires et peut provoquer une sensibilisation respiratoire et cutanée. Lors d’expositions répétées, une atteinte sévère du tractus respiratoire est observée.
Les tests de génotoxicité réalisés in vitro donnent des résultats positifs, alors que ceux menés in vivo s’avèrent négatifs ; cette différence s’expliquerait par la formation probable de TDA dans le milieu d'incubation des cellules. Des effets cancérogènes sont rapportés chez les rongeurs uniquement par voie orale. Aucun effet sur le développement ou la fertilité n’est mis en évidence chez le rat.
-
Toxicocinétique - Métabolisme
Chez l'animal
Absorption
Chez le rat, le taux d’absorption par voie orale du 2,4-TDI est compris entre 12 et 20 %, après administration d’une dose unique de 60 mg/kg par gavage ; par voie respiratoire, entre 60 et 90 % du 2,4-TDI inhalé est absorbé, à la suite d’une exposition à 2 ppm pendant 4 heures [21].
Très peu d’informations sont disponibles pour la voie cutanée. Suite à l’application de 330 mg/kg pc de 2,4-TDI sur la peau de rats pendant 8 heures maximum, moins de 1 % de la dose initiale est retrouvé dans l’urine, le sang et la carcasse [22].
Dans le milieu professionnel, les travailleurs sont exposés au TDI principalement par la voie respiratoire ; l’exposition par voie cutanée reste possible bien que le TDI soit peu absorbé par la peau. Après absorption, la grande majorité du TDI se combine facilement avec différentes macromolécules de l’organisme (dont les protéines), produisant ainsi des adduits qui vont rejoindre la circulation sanguine. Le TDI restant peut subir une hydrolyse acide et former les métabolites suivants : 2,4-toluène diamine (2,4-TDA) dans le cas de l’isomère 2,4-TDI, et 2,6-toluène diamine (2,6-TDA) dans le cas de l’isomère 2,6-TDI. Ceux-ci peuvent ensuite être acétylés ou bien réagir avec des molécules de TDI libres et former ainsi des polyurées.
La voie fécale est la principale voie d’excrétion chez des rats exposés au 2,4-TDI marqué au carbone 14 par la voie orale ou par inhalation. Les TDI et les TDA sous forme de conjugués sont détectés dans l’urine qui constitue la seconde voie d’élimination.
Distribution
Après inhalation de 2 ppm de 2,4-TDI radiomarqué pendant 4 heures, les niveaux les plus importants de radioactivité sont mesurés dans la carcasse, la peau et le tractus gastro-intestinal des rats [21]. A la suite d’une exposition de 4 heures (0,026 - 0,143 et 0,821 ppm, 14C-2,4-TDI), les niveaux les plus élevés de 2,4-TDI sont retrouvés dans le sang, le foie, l’estomac, les reins, les poumons et la trachée des rats [23].
De même, après ingestion, le 2,4-TDI est principalement retrouvé dans la peau, les poumons, le foie et les reins de rats ayant reçu par gavage 60 mg/kg 14C-TDI [21].
Suite à l’application de 330 mg/kg de 14C-2,4-TDI pendant 0,5 - 1 ou 8 heures sur la peau de rats, de très faibles quantités sont détectées dans la carcasse (0,25 - 0,44 et 0,52 % de la dose initiale) [22].
Métabolisme
A la suite d’une exposition par voie orale, le TDI peut subir une hydrolyse acide et former les métabolites suivants : 2,4-toluènediamine (2,4-TDA) dans le cas de l’isomère 2,4-TDI, et 2,6-toluènediamine (2,6-TDA) dans le cas de l’isomère 2,6-TDI. Ceux-ci peuvent ensuite être acétylés ou bien réagir avec des molécules de TDI libres et former ainsi des polyurées.
A contrario, après inhalation, une très faible proportion de TDI est hydrolysée en TDA, la majorité du TDI formant des adduits avec les macromolécules de l’organisme (conjugués labiles acides) [21].
Schéma métabolique
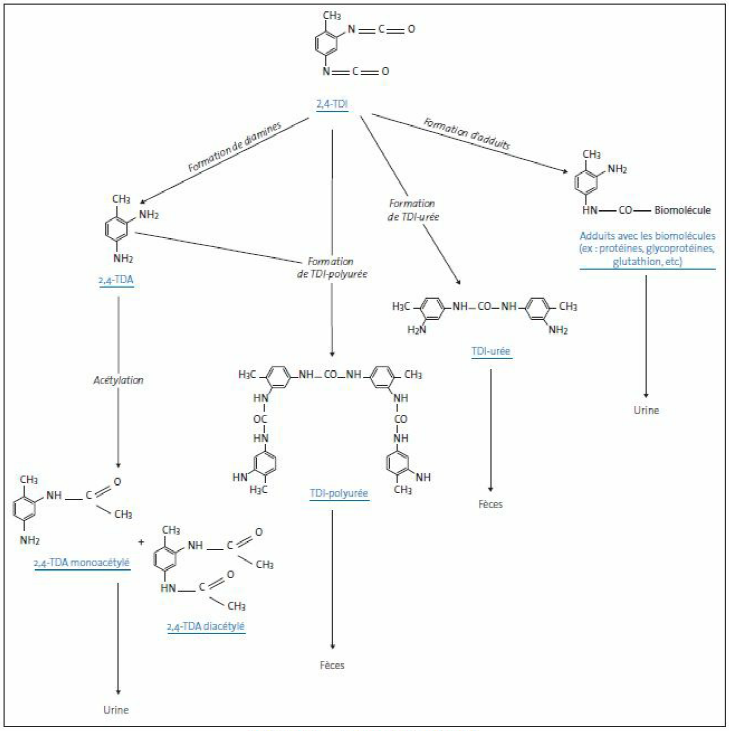
Métabolisme du 2,4-TDI (modifié d’après [52])
Excrétion
La voie fécale est la principale voie d’excrétion chez des rats exposés au 2,4-TDI marqué au carbone 14 par voie orale ou par inhalation. Les 2,4- et 2,6-TDI conjugués aux macromolécules, les TDA et leurs produits acétylés sont détectés dans l’urine qui constitue la seconde voie d’élimination [21].
Surveillance Biologique de l'exposition
Le dosage des TDA (2,4- et 2,6-, après hydrolyse), dans les urines recueillies pendant les 4 heures suivant la fin du poste, serait le meilleur reflet de l'exposition du jour même. Etant donné le risque de passage percutané, ce dosage sensible et spécifique est intéressant. Il est bien corrélé à l'intensité de l'exposition au TDI, mais cette corrélation n'est pas toujours retrouvée chez les travailleurs exposés en raison de l’influence de la charge de travail, de la pénétration percutanée, de la possible formation de TDA in situ sur le lieu de travail à partir du TDI lors de la dégradation thermique du polyuréthane.
Le dosage des TDA dans le plasma en fin de poste de travail reflète l'exposition cumulée des semaines précédentes. Cependant les données permettant de corréler l’exposition atmosphérique au TDI et les concentrations plasmatiques de TDA sont insuffisantes.
Les dosages du TDI total urinaire et plasmatique en fin de poste de travail ont été proposés mais étant donné l'hydrolyse rapide du produit, ces paramètres doivent être regardés avec prudence.
Le dosage des adduits TDI ou TDA aux protéines a été proposé, son intérêt mérite d’être démontré.
Pour les TDA urinaires, il existe des valeurs biologiques d’interprétation pour la population professionnellement exposée.
-
Mode d'actions
-
Toxicité expérimentale
Toxicité aiguë
La toxicité aiguë du TDI est résumée dans le tableau suivant [6]. La mortalité est causée par un œdème pulmonaire, une pneumonie et des hémorragies pulmonaires sévères [10].
Voie
Espèce
DL50 ou CL50 (4 heures)
Orale
Rat
4000 – 6000 mg/kg
Souris
4000 – 6000 mg/kg
Cutanée
Lapin
10 000 mg/kg
Respiratoire (aérosol)
Rat
0,1 mg/L (14 ppm)
Souris
0,07 mg/L (10 ppm)
Lapin
0,08 mg/L (11 ppm)
Cochon d’inde
0,09 mg/L (13 ppm)
Le TDI administré par voie orale chez des rats (dose unique par gavage, 2150-3160-4640-6810-10 000 ou 14 700 mg/kg) entraîne une diminution du poids moyen des mâles. Des lésions au niveau du tractus gastro-intestinal sont observées et, avant la mort, les animaux présentent une respiration difficile, un état léthargique et des diarrhées. Des cristaux blancs dans l’estomac et une coloration rouge foncé des poumons sont observés à la nécropsie [26].
Une exposition au 2,4-TDI par voie respiratoire chez la souris est à l’origine d’une irritation sensorielle avec baisse de la fréquence respiratoire : la RD50 est estimée entre 0,81 et 0,20 ppm (respectivement après 10 et 240 minutes d’exposition) [27]. Une RD50 de 0,26 ppm (après 180 minutes d’exposition) est obtenue pour le 2,6-TDI [28]. Des lésions sont observées au niveau du tractus respiratoire (inflammation, hyperplasie, dégénérescence, ulcération et métaplasie) et dépendent de la concentration [29].
Irritation, sensibilisation
Chez le lapin, une seule application cutanée de TDI (de 2,5 à 9,4 g/kg) provoque des symptômes d’irritation (érythème, œdème, puis nécrose) réversibles dans les 14 jours suivant l’exposition. Des tests d’irritation oculaire effectués chez le lapin démontrent des effets modérés à forts pour le TDI (opacité cornéenne réversible en 7 jours ou 30 jours chez quelques animaux, injection de l’iris réversible en 7 à 8 jours et conjonctivite avec écoulement purulent persistant pendant 18 à 20 jours chez quelques animaux).
Des tests de sensibilisation respiratoire réalisés chez le cochon d’Inde montrent une production d’anticorps à partir de 0,25 ppm de TDI inhalé pendant 5 jours. À partir de 3 ppm, on observe une hyperréactivité bronchique à l’histamine ainsi qu’une obstruction bronchique persistante [30]. Des études récentes ont mis en évidence une possible interdépendance de l’irritation respiratoire et de la sensibilisation, avec l’existence d’un seuil : chez les rongeurs, la dose sans effet pour la sensibilisation respiratoire est comprise entre 0,005 et 0,03 ppm, avec la survenue des 1ers effets entre 0,02 et 0,4 ppm [31].
Le test de maximalisation de Magnusson et Kligman effectué chez le cochon d’Inde, révèle pour l’isomère 2,4-TDI des effets sensibilisants cutanés modérés à forts. Chez la souris, le 2,4-TDI possède la capacité d’induire une hypersensibilité respiratoire à la suite d’une exposition cutanée [32].
Toxicité subchronique, chronique [26, 33]
Voie respiratoire
Une exposition subaiguë de 3 semaines (6 h/j, 5 j/sem) produit chez des rats une légère irritation des voies nasales à 0,24 ppm et une perte de poids, des changements progressifs de la fonction pulmonaire et quelques morts à 2,83 ppm. Pour ces doses, l’examen histopathologique montre des lésions de l’épithélium du tractus respiratoire. À partir de 5 ppm pendant 1 mois, 6 heures par jour, le TDI provoque la mort de tous les rats exposés, due à un blocage de la respiration par des débris muqueux provenant des bronches et de la trachée. Une exposition plus longue au TDI (0,1 ppm, 6 h/j, 1 fois/sem, 38 sem) entraîne la survenue de pneumopathies, trachéites et bronchites.
Une exposition chronique de 2 ans au TDI (souris et rats, 6 h/j, 5 j/sem, 0,05 et 0,15 ppm) est à l’origine d’une augmentation dose-dépendante des rhinites nécrotiques ou chroniques et des effets sur le tractus respiratoire inférieur (pneumonie interstitielle, bronchite catarrhale) chez les souris des 2 sexes, ainsi qu’une augmentation du taux de mortalité à toutes les doses chez les souris femelles. Les rats exposés présentent des effets mineurs : diminution du gain de poids et rhinites chroniques, à 0,05 et 0,15 ppm [34].
Les effets sont également sévères chez le cochon d’Inde exposé pendant un mois à plus de 35 ppm de TDI (réactions asthmatiques au cours des premières inhalations, puis dyspnée continue jusqu’à la fin de l’étude, survenue de bronchiolite oblitérante, pneumonie et emphysème avec peu de guérison) et chez le chien (1,5 ppm, 30 - 120 min/j, 4 mois) : larmoiement, toux, agitation, inflammation de la trachée et des grosses bronches, hypersécrétion de mucus épais dans les bronches et les bronchioles.
Voie orale
L’administration de TDI par gavage pendant 14 jours (0-30-60-120-240 ou 500 mg/kg) entraîne, chez le rat, une diminution du gain de poids à partir de 60 mg/kg/j. Des bronchopneumonies sont observées chez des rats exposés pendant 13 semaines à 240 mg/kg/j de TDI, avec une plus forte incidence chez les mâles, mais également à toutes les doses testées lors d’une étude chronique de 2 ans (30 et 60 mg/kg pc/j pour les mâles ; 60 et 120 mg/kg pc/j pour les femelles [26].
Effets génotoxiques [35]
In vitro
Des études ont montré que le TDI produit une augmentation dose-dépendante de la fréquence des mutations chez plusieurs souches de Salmonella typhimurium (TA 98, TA 100 et TA 1538), en présence d’activation métabolique. De plus, les deux isomères 2,4-TDI et 2,6-TDI, testés isolément, montrent des effets mutagènes ponctuels dans le test de mutation au locus tk sur cellules L5178Y (cellules de lymphome de souris), avec activation métabolique. Le TDI donne également des résultats positifs dans le test de mutation létale récessive liée au sexe chez la drosophile.
Dans les lymphocytes humains, le TDI produit des cassures de l’ADN et des aberrations chromosomiques, mais aucun échange de chromatides sœurs ou de transformation cellulaire n’a été mis en évidence. Dans les cellules ovariennes de hamster, le 2,6-TDI induit des échanges de chromatides sœurs et des aberrations chromosomiques, sans activation métabolique ; dans les mêmes conditions avec le 2,4-TDI, des résultats équivoques sont obtenus en ce qui concerne les échanges de chromatides sœurs et aucune aberration chromosomique n’est observée.
In vivo
L’administration de TDI par voie respiratoire (0,05 ou 0,15 ppm, 6h/j, 5 j/sem, 4 sem) n’induit pas d’augmentation significative des micronoyaux dans les érythrocytes de moelle osseuse, chez le rat et la souris [34].
Effets cancérogènes [26]
Des études de toxicité chronique sur deux ans ont été effectuées chez des rongeurs, recevant du TDI par voie orale (30 et 60 mg/kg pc/j pour les rats mâles, 120 et 240 mg/kg pc/j pour les souris mâles, 60 et 120 mg/kg pc/j pour les femelles).
Chez les rats mâles, une augmentation dose-dépendante de l’incidence des fibromes et/ou des fibrosarcomes sous-cutanés, d’adénomes des cellules acineuses pancréatiques et d’adénomes et de carcinomes des îlots de Langerhans est observée. Cette augmentation est significative à la plus forte dose testée. Les rats femelles présentent, quant à elles, une augmentation significative de l’incidence des fibroadénomes mammaires aux 2 doses et, à la plus forte dose testée, une augmentation de l’incidence des adénomes des îlots de Langerhans et des tumeurs sous-cutanées.
Chez les souris femelles, une augmentation dose-dépendante des incidences combinées d’hémangiomes (de la rate et des tissus sous-cutanés) et d’hémangiosarcomes (du foie, des ovaires et du péritoine) ainsi que d’adénomes hépatocellulaires a été rapportée. Aucune augmentation de la fréquence d’apparition des tumeurs n’a été signalée chez les souris mâles, probablement en raison du faible nombre de survivants.
Aucun effet cancérogène n’est observé chez le rat et la souris exposés par inhalation au TDI (0 - 0,05 - 0,15 ppm, 6 h/j, 5 fois par semaine, pendant 2 ans, corps entier).
Les tumeurs observées par voie orale sont probablement liées à la conversion rapide en milieu acide du TDI en TDA, cancérogène avéré pour les rongeurs. Certains auteurs ont donc suggéré que la conversion du TDI en TDA, nécessaire au développement de tumeurs, ne se produirait pas dans les conditions physiologiques d’exposition et que le mécanisme de cancérogénicité n’était donc pas pertinent pour les salariés exposés par inhalation [10, 36].
Fertilité
Les effets du TDI sur la fertilité ont été évalués lors d’une étude sur deux générations chez des rats exposés par inhalation (6 h/j, 5 j/sem, 10 sem puis 7 j/sem après accouplement) à des vapeurs de TDI (0,02 - 0,08 - 0,3 ppm). Une diminution du poids corporel ainsi que le développement de rhinites sont décrits chez les parents des deux générations F0 et F1. Cependant, aucun effet sur la fertilité, ni d’anomalie au niveau des organes reproducteurs, ni d’effets sur la gestation ou sur la lactation, n’a été observé. Seule une diminution du poids corporel et du gain de poids apparaît au cours de la lactation dans la génération F2 pour des concentrations de TDI de 0,08 et de 0,3 ppm [37].
Développement
Lors d’une étude de développement, menée chez des rats femelles gravides exposées à des vapeurs de TDI (0,02 - 0,1 - 0,5 ppm, 6 h/j, du 6ème au 15ème jour de gestation), une diminution du poids corporel et de la consommation alimentaire, ainsi qu’une respiration difficile et des sécrétions nasales, ont été observées chez les mères à la plus forte concentration. L’exposition au TDI n’a pas provoqué de perte pré- ou post-implantatoire, de changement du sexe ratio et du poids fœtal, d’augmentation de malformations et de variations [38].
-
Toxicité sur l’Homme
L’exposition aiguë à des vapeurs ou aérosols de TDI peut provoquer une irritation des yeux et des voies aériennes supérieures et inférieures. L’exposition chronique au TDI peut être à l’origine d’un asthme professionnel, ainsi que d’un déclin accéléré de la fonction respiratoire. Plus rarement, des dermatites de contact allergiques ou irritantes, ainsi que des pneumopathies d’hypersensibilité sont observées. Les données disponibles ne permettent pas de conclure quant aux éventuels effets génotoxiques et cancérogènes du TDI. Aucune donnée concernant des effets sur la reproduction n’est disponible chez l’homme.
Toxicité aiguë [10, 29, 33, 39-41]
L’exposition aiguë à des vapeurs ou aérosols de TDI peut provoquer une irritation des yeux et des voies aériennes supérieures et inférieures, un syndrome d’irritation bronchique aigu (RADS ou syndrome de dysfonction réactive des voies respiratoires) avec dans certains cas persistance d’une hyperréactivité bronchique à distance de l’épisode d’exposition, voire une pneumonie chimique et un œdème pulmonaire lésionnel en cas d’exposition massive.
Des expositions allant jusqu’à 0,02 ppm de TDI pendant 15 min semblent sans effet adverse notable chez les sujets sains. Chez les sujets asthmatiques ou présentant une hyperréactivité bronchique non spécifique, des symptômes respiratoires peuvent être observés pour des concentrations de TDI de 0,01 à 0,02 ppm, voire de l’ordre de 0,001 ppm chez ceux présentant un asthme au TDI.
Dans une étude d’exposition contrôlée, 3 des 10 volontaires sains exposés à 0,02 ppm de TDI pendant 2 heures ont rapporté une irritation oculaire et/ou une toux ; 1 des 15 volontaires asthmatiques (sans sensibilisation au TDI) exposés à 0,01 puis à 0,02 ppm pendant 1 heure consécutivement, a présenté une réaction asthmatique sévère après 15 minutes d’exposition à 0,01 ppm, et 4 ont manifesté des symptômes de type constriction thoracique, toux, dyspnée, rhinite, irritation de la gorge.
Chez 6 volontaires sains exposés quotidiennement à différentes concentrations de TDI (2,4- et 2,6-TDI, 65:35, 2,4- ou 2,6-TDI) jusqu’à 30 minutes (0,01-1,3 ppm, une concentration par jour, nombre de jours non précisé), une légère irritation oculaire et nasale est notée à 0,05 et 0,08 respectivement, une irritation marquée oculaire et naso-pharynhgée chez l’ensemble des sujets (larmoiement, picotement oculaire et nasal, rhinite, sensation de brûlures de la gorge) à 0,5 ppm, une irritation intolérable avec persistance de rhinite et toux plusieurs heures après arrêt de l’exposition chez les 2 sujets exposés à 1,3 ppm pendant 10 minutes.
Toxicité chronique [10, 29, 33, 40, 41]
Le TDI est un sensibilisant reconnu par voie cutanée ou respiratoire. L’exposition chronique au TDI peut être à l’origine d’un asthme professionnel, ainsi que d’un déclin accéléré de la fonction respiratoire. Les dermatites de contact allergiques et les pneumopathies d’hypersensibilité sont plus rares.
Asthme [42]
La symptomatologie associant toux sèche, dyspnée, rhinite et sifflements survient le plus souvent après une période de latence variable (de quelques semaines à plus de 10 ans). La réponse est le plus souvent retardée mais elle peut également être immédiate ou double. Le mécanisme impliqué peut être immunologique (IgE-dépendant ou non) ou non immunologique. Une réactivité croisée entre différents diisocyanates a été décrite.
La relation dose-réponse n’est pas complètement établie et il est difficile de définir un seuil sans effet. Les rôles respectifs de la concentration atmosphérique moyenne sur 8 heures et des pics d’exposition dans l’apparition de l’asthme au TDI ne sont pas élucidés. L’incidence annuelle de l’asthme au TDI semble décroître au fil des années avec la baisse des niveaux d’exposition au TDI en milieu professionnel, elle serait inférieure à 1 % lorsque la concentration moyenne de TDI sur 8 heures est maintenue en deçà de 0,005 ppm. Chez certains sujets présentant un asthme au TDI, la réponse pulmonaire peut être observée pour des concentrations aussi basses que 0,001 ppm lors de tests de provocation bronchique.
Déclin accéléré de la fonction respiratoire
Certaines études ont montré une diminution du VEMS (volume expiratoire maximal seconde) pouvant être secondaire à un asthme persistant ou sévère ou en rapport avec l’inflammation chronique des voies aériennes basse consécutive à l’exposition répétée à des irritants associée à l’exposition au TDI ; d’autres n’ont pas retrouvé une telle association. Dans les publications les plus récentes, il n’y a pas de preuve consistante d’un déclin accéléré du VEMS chez des salariés exposés à des niveaux inférieurs à 0,005 ppm de TDI en moyenne sur 8 heures.
Pneumopathie d’hypersensibilité (PHS) [43, 44]
C’est une affection rare dont la présentation clinique est similaire à celles des PHS secondaires à d’autres étiologies : dans les formes aiguës, il s’agit d’un syndrome pseudo-grippal avec fièvre, toux, dyspnée survenant dans les 2 à 9 heures après l’exposition. Le plus souvent, le scanner thoracique montre un aspect réticulonodulaire ou en verre dépoli, les épreuves fonctionnelles respiratoires retrouvent une atteinte de la DLCO (mesure de la diffusion du monoxyde de carbone) et un syndrome restrictif, une lymphocytose est présente dans le liquide de lavage bronchoalvéolaire. La recherche d’IgG spécifiques n’est pas toujours positive. L’éviction professionnelle semble être le facteur le plus déterminant pour une évolution favorable même si elle n’est pas toujours suffisante pour éviter l’apparition d’une fibrose pulmonaire.
Dermatites de contact allergique / d’irritation
Des dermatites de contact sont plus rarement rapportées. Dans une étude finlandaise chez 345 sujets testés avec la batterie « isocyanates » entre 1998 et 2010, 23 présentaient un patch-test positif à au moins un monomère dont 6 au TDI [45]. Une pertinence clinique a été retrouvée pour 1 des sujets, exposé au TDI contenu dans un durcisseur de peinture. De plus, 1 sujet avait une réaction douteuse et était exposé à de minimes quantités de TDI dans des mousses plastiques, 1 sujet était exposé à d’autres diisocyanates que le TDI (MDI et IPDI) et enfin 1 sujet avait une possible exposition antérieure aux isocyanates ; aucune autre source de sensibilisation n’a été retrouvée.
Des dermatites de contact d’irritation au TDI sont également décrites, notamment chez des salariés de la production de mousse polyuréthane [46].
Signes d’irritation oculaire
Aux faibles niveaux d’exposition, des signes oculaires peuvent accompagner la symptomatologie respiratoire. Ainsi, chez 136 travailleurs exposés à une concentration atmosphérique moyenne de TDI inférieure à 0,001 ppm, une fréquence accrue de signes d’irritation oculaire (prurit, larmoiement, brûlures), de signes d’atteinte des voies aériennes inférieures (toux sèche, sifflements, dyspnée), ainsi que d’épistaxis est observée, avec une relation dose-réponse pour les symptômes oculaires (mesurages atmosphériques et biomarqueurs urinaires et plasmatiques) [47].
Effets génotoxiques
Une augmentation des aberrations chromosomiques structurelles, des échanges de chromatides sœurs et des micronoyaux dans les lymphocytes périphériques est retrouvée dans une étude réalisée chez 26 salariés de la production de plastiques exposés au TDI (0,00001-0,002 ppm) comparés à 21 témoins non exposés. Le faible effectif et l’absence de prise en compte de facteurs de confusion comme le tabagisme et l’âge ne permettent pas de conclure quant aux effets génotoxiques du TDI [48].
Une étude d’exposition contrôlée de courte durée aux diisocyanates a été réalisée chez 42 travailleurs présentant des symptômes respiratoires en rapport avec une exposition professionnelle aux diisocyanates [exposition à différents isocyanates (MDI, n=25 ; TDI, n=5 ; HDI, n=12) à une concentration de 0,005-0,03 ppm pendant 2 heures], 10 témoins avec asthme léger (exposition au TDI, puis au MDI) et 10 témoins sains, non exposés aux diisocyanates [49]. Il n’a pas été montré de différence dans la fréquence des cassures double brin de l’ADN mesurées par le test des comètes, dans les lymphocytes périphériques des volontaires, en comparant les trois groupes de sujets ou en comparant avant et après exposition aux diisocyanates.
Effets cancérogènes
Lors de sa dernière évaluation en 1999, le CIRC a conclu que les trois études de cohorte (Etats-Unis, Suède et Royaume Uni) et l’étude cas-témoins examinées ne retrouvaient pas d'association évidente entre l'exposition au TDI et la survenue de cancers [35]. Un risque accru de décès par cancer du poumon est retrouvé uniquement chez les femmes dans la cohorte britannique (risque non significativement augmenté dans la cohorte américaine), confirmé par la mise à jour des données des cohortes britannique [50] et suédoise [51]. Cependant, l’absence d’effet similaire chez les hommes, les co-expositions et l’absence de relation dose-effet ne sont pas en faveur d’une association causale entre cancer du poumon et l’exposition au TDI (aucune des études citées ci-dessus ne prend en compte le tabagisme notamment).
Effets sur la reproduction
Aucune donnée n’est disponible chez l’homme à la date de publication de cette fiche toxicologique.
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
