Pathologie - Toxicologie
-
Toxicocinétique - Métabolisme [6, 7, 10, 11, 14]
Le MTBE est bien absorbé, chez l’homme et les rongeurs, par voie orale et par inhalation. L’absorption cutanée est modérée chez l’animal sous occlusion et fortement limitée par l’évaporation en milieu ouvert. Le MTBE se distribue largement dans les tissus de l’homme et de l’animal ; il y est métabolisé de façon similaire quelle que soit l’espèce et éliminé majoritairement dans l’urine, sous forme de métabolites, et dans l’air expiré sous forme non modifiée.
Chez l'animal
Absorption
Chez le rat, le MTBE est rapidement et complètement absorbé dans le tractus gastrointestinal, le pic plasmatique est atteint 15 minutes après l'administration.
Après exposition cutanée, l'absorption est faible sous occlusion (16 % de 40 mg/kg et 34 % de 400 mg/kg) ; en milieu ouvert, elle est fortement limitée par une rapide évaporation de la substance. Le pic plasmatique est atteint après 2 à 4 heures. Des études in vitro ont montré que le flux du MTBE (solution à 15 %) à travers la peau du rat est fonction de la concentration avec un maximum à 290 µg/cm2/min ; les flux correspondants à travers des échantillons de peau humaine sont 2 à 14 fois plus faibles. Après inhalation, la concentration plasmatique maximale est atteinte 4 à 6 heures après l'exposition, l'absorption pulmonaire correspond à environ 50 % d'une concentration de 400 ppm pendant 6 heures.
Chez l'homme, le MTBE est rapidement absorbé par inhalation (32 à 42 % d'une concentration de 5 à 50 ppm pendant 2 heures, chez des volontaires). Le passage dans le sang est rapide et linéaire ; le pic plasmatique est atteint à la fin de l'exposition [12]. L'absorption par voie orale est plus lente et moins importante [13].
Distribution
En dehors d'une fixation spécifique à une protéine rénale (alpha 2u-globuline) chez le rat mâle, la large distribution tissulaire du MTBE, chez l'homme et l'animal, est régie par sa solubilité : la concentration dans les tissus mous est semblable à celle du sang, celle dans le tissu adipeux peut atteindre des valeurs 10 fois supérieures. Le MTBE n'est pas stocké à long terme dans l'organisme.
Métabolisme
La métabolisation du MTBE est similaire chez le rat et l'homme (fig. 1). La première étape, réalisée par les enzymes microsomiales, est une déméthylation oxydative du MTBE en formaldéhyde et tert-butanol. Cette réaction impliquerait des enzymes à cytochrome P450 (CYP) : chez l'homme, CYP 2A6 et CYP 2E1 sont présents en quantités significatives uniquement dans le foie, chez le rat, CYP 2B1 et CYP 2E1 dans le foie, CYP 2A3 dans l'épithélium olfactif et nasal. Le formaldéhyde et le méthanol n'ont été mis en évidence qu'in vitro ; in vivo, le formaldéhyde serait rapidement transformé en acide formique et incorporé dans le pool des molécules à 1 carbone et/ou converti en CO2. La métabolisation du MTBE est saturable chez le rat lors d'une exposition par inhalation à 8 000 ppm pendant 6 heures mais pas chez l'homme jusqu'à 75 ppm pendant 4 heures. Le MTBE est inducteur de son propre métabolisme ; des expositions répétées induisent les enzymes à cytochromes P450 et accélèrent la métabolisation.
Schéma métabolique
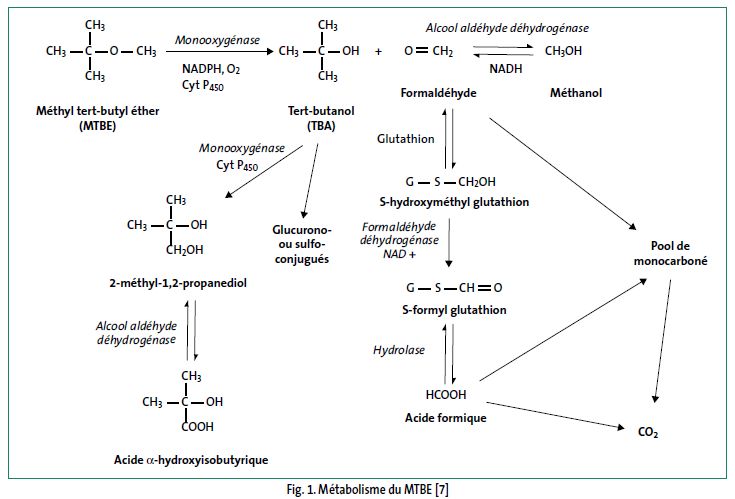
Excrétion
Le MTBE est rapidement éliminé du plasma sanguin, après exposition orale ou inhalatoire, avec une demi-vie de 0,5 heure chez le rat, et environ 5 heures chez l'homme. Après exposition cutanée, la demi-vie d'élimination plasmatique est de 1,8 à 2,3 heures chez le rat.
Chez le rat, l'excrétion du MTBE est différente selon la voie d'exposition et la dose :
- par voie cutanée, les pourcentages de la dose absorbée éliminés dans l'urine (16 %) et l'air expiré (18 %) sont identiques, le métabolisme n'est pas saturable aux plus fortes doses étudié es (400 mg/kg) ;
- par inhalation et par voie orale, le métabolisme est saturable : à fortes concentrations (8 000 ppm), une proportion plus importante de la dose absorbée est éliminée sous forme inchangée dans l'air expiré (53 %) et une plus faible quantité de métabolites est mesurée dans l'urine (42 %). À faible concentration (400 ppm), l'excrétion est semblable après administration d'une dose unique ou répétée : 20 - 17 % dans l'air expiré et 65 - 72 % dans l'urine.
La plus grande partie du MTBE est éliminée dans l'urine sous forme métabolisée (tert-butanol libre et glucurono- ou sulfo-conjugué, 2-méthyl-1,2-propanediol, acide α-hydroxyisobutyrique) et dans l'air expiré, majoritairement sous forme de MTBE inchangé (> 95 % après exposition cutanée et 66 - 80 % après inhalation) ou métabolisé en tert-butanol.
Une très faible part est éliminée dans les fèces (< 2 %).
Les métabolites urinaires sont éliminés avec des demi-vies de 2,9 à 5 heures chez le rat et 7,8 à 17 heures chez l'homme. La proportion de MTBE exhalée chez le rat dépend directement de la dose d'exposition (23,2 %, 37,6 %, ou 69 % à 50, 100, ou 500 mg/kg, respectivement) par suite de la saturation métabolique. L'excrétion est totale en 24 - 48 heures.
L'exposition au MTBE a été évaluée par des dosages sanguins ou urinaires. Il existe une bonne corrélation entre les concentrations atmosphériques et les dosages sanguins de MTBE, mais pas de ses métabolites. Dans les urines, les dosages de MTBE en fin de poste et du métabolite TBA (tert-butanol) avant le début du poste suivant pourraient être utilisés pour la surveillance du personnel exposé [29, 30, 31].
-
Mode d'actions
-
Toxicité expérimentale
Toxicité aiguë [6, 7]
La toxicité aiguë du MTBE est faible. A forte dose, il induit hypoactivité, dépression du système nerveux central et ataxie. C’est un irritant cutané modéré et un irritant oculaire faible ; il occasionne une irritation sensorielle respiratoire mais pas de sensibilisation cutanée.
La DL50 orale est de 3 800 - 4 000 mg/kg chez le rat, la DL50 cutanée est > 10 000 mg/kg chez le rat et le lapin, et la CL50 par inhalation est de 85 - 140 mg/L/4h (environ 24 000 - 40 000 ppm) chez le rat et la souris. Des expositions intermittentes de rats, pendant 5 jours, ou de souris, pendant 13 jours, à des concentrations < 8 000 ppm ne sont pas létales.
Après exposition par voie orale, les symptômes les plus typiques sont une piloérection et une posture voûtée (2 000 mg/kg par gavage) ; à des doses supérieures (jusqu'à 10 000 mg/kg), on observe une irritation du tractus gastro-intestinal avec des diarrhées, une baisse de la coordination musculaire, une hypoactivité, une hyperpnée, une dépression du système nerveux central, une anesthésie passagère et une ataxie. Aux effets sur le système nerveux central s'ajoutent, après exposition par inhalation, une irritation respiratoire, nasale et oculaire, ainsi qu'une respiration laborieuse (à partir de 19 000 ppm chez le rat) et, par voie cutanée, un érythème léger au site d'application.
Des expositions répétées (3 000 ppm, 6 h/j pendant 5 jours) provoquent, chez le rat des deux sexes, une augmentation de poids des reins et, chez le mâle uniquement, de la prolifération des cellules épithéliales rénales dans les tubes contournés proximaux ; chez la souris des deux sexes (8 000 ppm), on note une augmentation de poids du foie et de la prolifération des cellules hépatiques.
Le MTBE est irritant pour la peau du lapin, il déclenche un érythème modéré à sévère et un œdème modéré ; ces effets sont réversibles en 14 jours. L'irritation oculaire est plus faible : chez le lapin, elle se traduit par un érythème léger, une congestion de la conjonctive et une hypersécrétion lacrymale. Ces effets sont réversibles en 3 à 7 jours. Les vapeurs de MTBE sont irritantes pour le tractus respiratoire, elles provoquent une irritation sensorielle avec une RD50 égale à 16,6 mg/L/1 h (4 600 ppm) chez la souris.
Le MTBE n'est pas sensibilisant dans le test de Magnusson et Kligman, chez le cobaye, à la concentration de 1 % dans l'eau.
Toxicité subchronique, chronique [6, 7]
Le MTBE provoque, chez le rat, lors d’expositions répétées, à fortes doses, par voie orale et par inhalation, une atteinte du système nerveux central, une irritation du tractus gastrointestinal et respiratoire, une légère modification des paramètres sériques dans les 2 sexes et une néphropathie chronique, spécifique du rat mâle.
Chez le rat, par voie orale (357, 714, 1 071 et 1 428 mg/kg/j pendant 14 jours ou 90, 440 et 1 750 mg/kg/j pendant 28 jours), le MTBE provoque, aux fortes doses, une anesthésie profonde et des diarrhées, une baisse de la prise de poids observée dans les deux sexes et du poids des poumons chez les femelles, une augmentation du nombre de globules rouges, du taux d'hémoglobine et du taux sérique de glucose, de créatinine et d'urée. Les mâles présentent une néphropathie avec augmentation de poids des reins et formation de gouttelettes hyalines dans les cellules épithéliales du tube proximal.
En exposition subchronique (100, 300, 900 et 1 200 mg/kg/j pendant 90 jours), les symptômes cliniques sont identiques, le taux sérique d'urée diminue et celui du cholestérol augmente, la néphropathie est plus sévère, le poids du foie et des reins augmente en fonction de la dose dans les deux sexes et celui des surrénales à forte dose chez les femelles[15]. Le NOAEL est égal à 90 mg/kg/j pour une exposition de 28 jours et 300 mg/kg/j pour une exposition de 90 jours.
Des rats et des souris exposés par inhalation (diverses expérimentations de 250 à 8 000 ppm, 6 h/j, 5 j/sem, 4 semaines, 13 semaines ou 18 mois) présentent, à forte concentration, des symptômes identiques à ceux manifestés après exposition par voie orale : ataxie et hypoactivité (33 000 ppm), augmentation du poids du foie (34 000 ppm), des reins (rats mâles 3 800 ppm, femelles 33 000 ppm/13 semaines ; souris mâles 400 ppm, femelles 38 000 ppm/18 mois), augmentation du taux sérique de corticostérone et d'aldostérone (rat, 8 000 pm/13 semaines) et accumulation protéique dans le tube rénal (rat mâle, 3 000 ppm/5 semaines). À l'autopsie, l'examen microscopique effectué chez le rat ne révèle ni lésion du système nerveux central ou périphérique, ni modification hépatique, ni dépôt de cylindres protéiques alpha 2u-globuline positifs à la jonction du tube proximal et de l'anse de Henlé ; cependant, après 18 mois d'exposition, l'ampleur de la glomérulosclérose, de la protéinose tubulaire, de la néphrite et de la fibrose interstitielles augmente. La souris femelle, exposée à 8 000 ppm, présente, après 4 ou 8 mois, des modulations hormonales de type anti-œstrogénique (baisse de poids de l'utérus, des ovaires et de l'hypophyse ; diminution des glandes utérines ; altération des phases et de la longueur du cycle œstral) [22] et, après 18 mois, une hypertrophie hépatocellulaire.
Le NOAEL est de 400 - 800 ppm pendant 13 semaines et 400 ppm pendant 18 mois.
Effets génotoxiques [6, 7]
La majorité des tests de génotoxicité pratiqués in vitro ou in vivo donnant des résultats négatifs, le MTBE est présumé non mutagène.
Les résultats des tests de mutagenèse effectués in vitro, avec ou sans activateur métabolique, sont en général négatifs (Ames sur S. typhimurium TA 98 - TA 100 - TA 1535 - TA 1537 - TA1538 ; mutation génique sur S. cerevisiae et cellules V79 de hamster ; cytogénétique : aberrations chromosomiques et échanges entre chromatides sœurs sur cellules ovariennes de hamster chinois ; synthèse non programmée d'ADN sur hépatocytes de rat). Les résultats positifs obtenus, dans le test d’Ames avec la souche TA102 de S. typhimurium (légèrement positifs avec activateur et modérément positif sans activateur) et dans le test de mutagenèse avec les cellules de lymphome de souris, pourraient être dus à la formation in vitro de formaldéhyde [16].
Le MTBE n'est pas génotoxique dans les tests pratiqués in vivo : aberrations chromosomiques dans la moelle osseuse de rat et de souris après exposition par voie orale (30, 96, ou 296 mg/kg/j) ou par inhalation (400 à 8 000 ppm, 6 h/j, 2 ou 5 jours ) ; synthèse non programmée d’ADN dans les hépatocytes de souris ; létalité dominante liée au sexe chez la drosophile.
Le potentiel génotoxique des métabolites du MTBE a également été testé : le formaldéhyde donne des résultats positifs in vitro et équivoques in vivo alors que le TBA, dans les deux cas, n’est pas génotoxique.
Effets cancérogènes [6, 7]
Les études de cancérogenèse indiquent que le MTBE peut provoquer des tumeurs par différentes voies d’administration :
- chez le rat (par voie orale : lymphomes, adénomes testiculaires ; par inhalation : adénomes et carcinomes du rein, adénomes testiculaires),
- chez la souris (adénomes et carcinomes hépatiques par inhalation).
Après inhalation d’une concentration toxique (3 000 ppm, 6 h/j, 5 j/sem, 24 mois), le MTBE induit des adénomes et des carcinomes du tube rénal chez le rat F344 mâle, probablement en réponse à une néphropathie à alpha 2u-globuline, et une augmentation du nombre de tumeurs des cellules interstitielles de Leydig dans les testicules, sans signe de dégénérescence testiculaire ou d’atrophie[17]. Une augmentation des tumeurs des cellules de Leydig est aussi observée chez le rat Sprague-Dawley mâle, après administration orale de 1 000 mg/kg/j [18 à 20].
Le MTBE induit, chez le rat femelle exposé par gavage (250 et 1 000 mg/kg , 4 j/sem, 104 sem), une augmentation, liée à la dose, de la prolifération des tissus lymphoréticulaires.
Cette dysplasie est associée à une transformation néoplasique, le plus fréquemment sous forme de lymphome lympho-immunoblastique situé essentiellement dans les poumons mais aussi dans la rate, le foie et les ganglions lymphatiques[18 à 20].
L’inhalation de 8 000 ppm (6 h/j, 5 j/sem, 18 mois) induit des adénomes et des carcinomes hépatiques chez la souris femelle [15].
Le MTBE n’a pas d’activité promotrice sur le foie de souris après induction par la N-nitrosodiéthylamine [21].
Mécanisme de la carcinogenèse du MTBE
Les mécanismes par lesquels le MTBE induit des tumeurs chez l’animal de laboratoire ne sont pas complètement identifiés, le formaldéhyde et le TBA pourraient jouer un rôle.
Si le MTBE présente un faible potentiel génotoxique, il semble altérer les fonctions endocrines. De plus, il présente des points communs avec une classe de produits chimiques tumorigènes, pour le rein du rat mâle uniquement, par interaction avec une protéine spécifique de cette espèce, l'alpha 2u-globuline, sans pour autant posséder tous les critères de ce groupe de substances ; entre autres, il n'y a pas été montré d'accumulation rénale de cylindres protéiques.
L'augmentation du nombre de tumeurs rénales pourrait aussi être associée à la synthèse métabolique de TBA. Le TBA induit, chez le rat mâle, des adénomes et des carcinomes rénaux, chez la souris femelle, une hyperplasie et des adénomes des cellules folliculaires de la thyroïde et, chez la souris des 2 sexes, une hyperplasie de la vessie.
L'augmentation des lymphomes serait associée à deux mécanismes : d'une part, la formation de formaldéhyde, qui induit des cancers hématopoïétiques chez l'homme et l'animal, et d'autre part, l'effet anti-œstrogénique ; les œstrogènes seraient des régulateurs négatifs de la prolifération des lymphocytes [22].Ces tumeurs sont obtenues sur différentes souches de rats (Sprague - Dawley, F344), et en des sites multiples. Cependant, différentes instances internationales (NTP(1) , EPA(2), Union Européenne) ne l’ont pas classé comme cancérogène. Le CIRC (IARC(3)) a classé le MTBE dans le groupe 3 (agent ne pouvant pas être classé quant à sa cancérogénicité pour l’homme en raison d’indications insuffisantes chez l’homme et d’indications limitées chez l’animal) et l’ACGIH(4) dans le groupe A3 (cancérogène pour l’animal par des mécanismes non applicables à l’homme).
(1) National Toxicology Program.
(2) Environmental Protection Agency.
(3) Centre international de recherche sur le cancer.
(4) American Conference of Gouvernmental Industrial Hygienists.Effets sur la reproduction [6, 7, 23-25]
Le MTBE n’a pas d’effet sur la reproduction des rats ni sur le développement du rat et du lapin, même à des concentrations toxiques pour les mères. Chez la souris, il n'est embryotoxique, fœtotoxique et tératogène qu'à des concentrations toxiques pour les mères.
L'exposition au MTBE par inhalation n'induit pas de modification macroscopique ou histologique du système reproducteur des rats mâles ou femelles (concentrations < 3 000 ppm, 9 j), ou de la souris mâle ( < 8 000 ppm, 13 j). Une exposition à plus long terme (< 8 000 ppm, 10 semaines avant accouplement, 1 - 3 semaines pendant l'accouplement, 3 semaines de gestation et 3 semaines postnatales) n'a pas d'effet sur les paramètres de la reproduction des parents (F0) et des petits de la première génération (F1).
Le MTBE n'a pas d'effets sur le développement à des concentrations < 2 500 ppm du 6ième au 15ième jours de gestation chez le rat et la souris ou < 8 000 ppm du 6ième au 18ième jours de gestation chez le lapin. À 8 000 ppm, il induit, chez le rat, une baisse de poids fœtal. Par contre, chez la souris, il induit des modifications du développement en fonction de la dose :
- aucun effet à des concentrations < 2 500 ppm,
- 4 000 ppm : retard de l'ossification du squelette et de poids fœtal,
- 8 000 ppm : augmentation du nombre d'implants non-viables, de la résorption tardive, diminution du sex-ratio et du poids fœtal, augmentation des malformations (becs de lièvre, malformations squelettiques).
À des concentrations supérieures à 3 000 ppm chez le rat et 4 000 ppm chez la souris et le lapin, la toxicité maternelle est évidente (dépression du système nerveux central, baisse de poids et diminution de la prise de poids et de nourriture).
-
Toxicité sur l’Homme
Il existe peu de données toxicologiques humaines sur le MTBE seul ; la plupart des effets constatés concernent des expositions à des carburants qui peuvent contenir 10 à 15 % de cette substance. On ne peut alors pas dégager la toxicité propre du produit, notamment la toxicité chronique.
Toxicité aiguë [26-28]
Les données proviennent d'expositions particulières sans relation avec celles concevables en milieu professionnel. En effet, le MTBE est utilisé pour la dissolution de calculs biliaires de cholestérol ; il est alors instillé directement dans la vésicule. Dans ces conditions, diverses manifestations ont pu être observées : nausées, vomissements, vertiges mais aussi effet sédatif. Dans de rares cas, on note une gastrite ulcérative ou, en cas d'extravasation, une hémolyse associée à une atteinte rénale. Des anomalies minimes et transitoires des fonctions hépatiques sont parfois constatées dans ces conditions extrêmes d'exposition.
En milieu professionnel, certains travailleurs exposés se plaignent de céphalées, nausées, congestion nasale et irritation oculaire. Une concentration de 180 mg/m3 (50 ppm) pendant 2 heures ne provoque pas d'effet comparable chez des volontaires. Une irritation apparaît par contre à partir de 270 mg/m3 (80 ppm) [5].
Le MTBE ne semble pas irritant pour la peau.
Toxicité chronique
Il n'existe pas de données permettant d'évaluer les effets d'expositions chroniques au MTBE. La plupart des informations concernent des salariés exposés à des carburants contenant du MTBE ; aussi est-il difficile de déterminer la part de ce dernier dans les effets observés.
-
Interférences métaboliques
-
Cohérence des réponses biologiques chez l'homme et l'animal
