Prélèvement : Actif sur cassette ; tube de résine XAD7®
Analyse : HPLC détection UV
Données de validation : Validation complète
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Acrylamide | 79-06-1 | C3H5NO |
M1B R2 |
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Acrylamide | 71,09 |
Familles de substances
- AMIDES
Principe de prélèvement et d'analyse
-
État physique
Aérosols (mélange de gaz ou vapeurs / particules) -
Type de prélèvements
Actif -
Nom du dispositif
cassette ; tube de résine XAD7® -
Plus d'informations
-
Technique analytique
CHROMATOGRAPHIE EN PHASE LIQUIDE -
Injecteur
PASSEUR AUTOMATIQUE -
Détecteur
ULTRAVIOLET (UV)
Domaine d'application
| Substance | Quantité minimum sur le dispositif | Quantité maximum sur le dispositif | Concentration minimum | Concentration maximum | Volume maximum |
|---|---|---|---|---|---|
| Acrylamide | 1,5 µg |
300 µg |
3 µg/m3 |
600 µg/m3 |
480 L |
Méthode de prélèvement
En savoir plus sur ce type de prélèvement sur cassette
Deux dispositifs de prélèvement (en série) :
Dispositif N°1
-
Type dispositif
CASSETTE 37 mm 2 pièces -
Support ou substrat de collecte
- FILTRE FIBRE DE QUARTZ
-
Commentaires, conseils et consignes
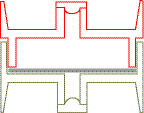
Dispositif N°2
-
Type dispositif
TUBE 110 mm diam 6 mm -
Support ou substrat de collecte
- RESINE XAD7®
-
Quantité de support dans la plage de mesure (mg)
100 -
Quantité de support dans la plage de garde (mg)
50 -
Commentaires, conseils et consignes
Les deux plages sont maintenues et séparées par des tampons de laine de verre

Schéma du dispositif en série
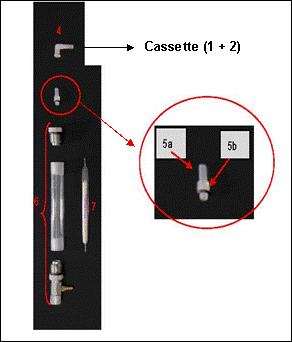

Le tube est placé dans un porte tube et raccordé à la cassette à l'aide de connexions de type luer en polypropylène afin d'assurer l'étanchéité entre cassette et tube. La perte de charge de l'ensemble est d'environ 9,22 kPa (37 pouces d'eau) à 1 L/min
Le détail et les références sont décrits dans les données de validation compléments.
Conditions de prélèvement
-
Débit de prélèvement (L/min)
1 -
Temps de prélèvement maximum en heures
8
Pompe de prélèvement
- Pompe à débit de 1 à 5 L/min compensant les fortes pertes de charges (sup, à 20 pouces d'eau)
Conditionnement particulier
-
Choix conditionnement particulier
stabilisation -
Description
- Immédiatement après le prélèvement, l’acrylamide peut être transféré en totalité sur l’adsorbant par pompage d’air propre pendant au moins 4 h.
- Les 2 éléments du dispositif (tube et cassette) doivent alors être dissociés, refermés hermétiquement et placés dans les conditions de conservation adaptées.
Les tubes stabilisés peuvent être conservés 8 jours à température ambiante. Une conservation à 4°C pendant 3 semaines de plus n’entraîne aucune perte d’acrylamide.
Les dispositifs non stabilisés (cassette et tube séparés, bouchés), peuvent être conservés à 4°C pendant 2 semaines sans perte d’acrylamide
Compléments

Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Durée de conservation prélèvements avant analyse
1 mois -
Conditions de conservation avant analyse
Les dispositifs peuvent être conservés avant d’être analysés :
- 15 jours à 4°C, pour la cassette et le tube séparés, bouchés, placés à 4°C aussitôt le prélèvement effectué,
- 8 jours à température ambiante ou un mois à 4°C, pour les tubes des dispositifs stabilisés.
-
Nombre d'étapes de préparation
3 -
Commentaires sur les étapes
La première étape décrit le traitement des cassettes ; la seconde le traitement de la première plage du tube et la troisième le traitement de la seconde plage.
Le protocole d’analyse décrit ci-après permet donc de prendre en compte les dépôts sur les parois des cassettes, d’analyser conjointement les échantillons de particules et de vapeur pour un même prélèvement et de s’assurer, au travers de l’analyse séparée de la 2° plage d’adsorbant, de l’absence de claquage du tube.
dans le cas de tubes stabilisés suivre la troisième étape de traitement en séparant les deux plages.
3 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- EAU
- METHANOL
-
Type de préparation
Percolation -
Volume
5 mL -
Commentaires
- Introduire par l’orifice d’entrée de la cassette (dans le sens du prélèvement d’air), 1 mL du solvant de désorption (eau/méthanol 95/5).
- Agiter manuellement la cassette rebouchée.
- L’adapter ensuite, par l'orifice de sortie débouché, à la station d’extraction sous vide dans laquelle a été placé un flacon taré pour la récupération du filtrat
- Introduire par l'orifice 4 mL du solvant de désorption.
- Récupérer l’éluat dans le flacon en appliquant un vide léger.
- Le flacon plein, bouché, est à nouveau pesé, pour déterminer le volume de solvant de désorption (densité d = 0,99).

Étape de préparation N°2
-
Séparation des plages
oui -
Solvant ou solution
- PERCOLAT CASSETTE
-
Type de préparation
Désorption -
Volume
5 mL -
Ultrasons
- Temps d'ultrasons : 4 min
-
Autres conditions de préparation
Transférer le tampon d’entrée du tube, la première plage de résine et le tampon séparateur dans le flacon contenant le percolat obtenu précédemment avec la cassette.
-
Filtration
Filtrer une aliquote de chacune des solutions de désorption sur filtre-membrane 0,45 µm et la transférer dans un flacon pour passeur d’échantillons
-
Commentaires
Étape de préparation N°3
-
Séparation des plages
oui -
Solvant ou solution
- EAU
- METHANOL
-
Type de préparation
Désorption -
Volume
5 mL -
Ultrasons
- Temps d'ultrasons : 4 min
-
Autres conditions de préparation
- Transférer la deuxième plage du tube (P2) dans un second flacon de verre de 10 mL. Ajouter 5 mL du solvant de désorption (eau/méthanol 95/5) dans ce flacon et fermer hermétiquement.
-
Filtration
Filtrer une aliquote de chacune des solutions de désorption (P1 + filtre, P2) sur filtre-membrane 0,45 µm et la transférer dans un flacon pour passeur d’échantillons
Une condition analytique :
Condition analytique N°1
-
Technique analytique
- CHROMATOGRAPHIE EN PHASE LIQUIDE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- PHASE INVERSE C18
-
Détecteur
- ULTRAVIOLET (UV)
-
Phase mobile
- EAU
- METHANOL
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- EAU
- METHANOL
-
Calcul de la quantité de substance sur le dispositif
La méthode permet de mesurer la concentration globale de substance dans l’air, sans chercher à quantifier séparément les particules en suspension.
Bibliographie
- Exposition sur les lieux de travail - Mesurage de l'agent chimique sous forme de mélange de particules aériennes et de vapeur - Exigences et méthodes d'essai. Norme NF EN 13936. La Plaine Saint Denis: AFNOR. 2014.
- Air des lieux de travail. Prélèvement et analyse des gaz et vapeurs organiques. Prélèvement par pompage sur tube à adsorption et désorption au solvant. Norme NF X 43-267. La Plaine Saint Denis: AFNOR. 2014.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 124/V01.01 | 15/12/2014 | Création |
|
| M-3/V01 | novembre 2015 | mise en ligne | tous |
Date de mise à jour : novembre 2015
Ancien numéro de fiche MétroPol : 124
