Prélèvement : Actif sur cassette avec filtres imprégnés
Analyse : électrophorèse capillaire
Données de validation : Validation partielle
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Anions minéraux |
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Anions minéraux |
|
Familles de substances
- ANIONS MINERAUX
Principe et informations
Elle s’applique aux acides minéraux (acides bromhydrique, chlorhydrique, fluorhydrique, nitreux, nitrique, phosphorique, sulfurique), à leurs sels présents dans l’atmosphère des lieux de travail sous forme de gaz, de particules ou de mélange des 2 phases (aérosols mixtes). Pour les composés particulaires fluorés insolubles se référer à la méthode Acide fluorhydrique et composés particulaires fluorés insolubles.
Les composés minéraux sous forme particulaire sont retenus sur un préfiltre (par exemple membrane en PTFE ou membrane PVC dans le cas des fluorures insolubles - voir Acide fluorhydrique et composés particulaires fluorés insolubles).
Les brouillards d'acides non volatils (acides sulfurique et phosphorique) sont également collectés sur le pré-filtre (et sur les parois).
Dans le cas des brouillards d'acides volatils (acides bromhydrique, chlorhydrique, fluorhydrique, nitreux, nitrique) la phase particulaire est collectée initialement sur le préfiltre (et sur les parois) puis ré-évaporée par le passage de l'air avant d'être piégée finalement sur un (ou plusieurs) filtre(s) imprégné(s). La phase gazeuse de ces brouillards est directement collectée sur le(s) filtre(s) imprégné(s).
Principe de prélèvement et d'analyse
-
État physique
Aérosols (mélange de gaz ou vapeurs / particules) -
Type de prélèvements
Actif -
Nom du dispositif
cassette avec filtres imprégnés -
Plus d'informations
-
Technique analytique
ELECTROPHORESE CAPILLAIRE -
Injecteur
PASSEUR AUTOMATIQUE -
Détecteur
ULTRAVIOLET (UV)
Réactifs
- ACIDE BORIQUE
- ACIDE TRIFLUOROACETIQUE
- CHROMATE DE SODIUM TETRAHYDRATE
- EAU
- MODIFICATEUR DE FLUX ELECTROOSMOTIQUE
Méthode de prélèvement
Généralité sur le prélèvement des aérosols
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
CASSETTE 37 mm 4 pièces -
Support ou substrat de collecte
- 2 FILTRES EN FIBRE DE QUARTZ IMPREGNES
- MEMBRANE PTFE (Téflon)
-
Préparation du substrat
Imprégner les filtres en fibres de quartz à l'aide d'une solution de Na2CO3 à 5 g / 100 mL dans l'eau, en déposant 500 µL de solution. Sécher à l'étuve à 50°C
-
Commentaires, conseils et consignes
Déposer au fond de la cassette 1 filtre en fibre de quartz imprégné, puis au premier étage un second filtre imprégné puis au second étage la membrane PTFE ≤ 1 µm
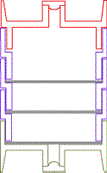
Conditions de prélèvement
-
Débit de prélèvement (L/min)
2 -
15 minutes (VLEP-CT possible dans ces conditions)
oui -
Temps de prélèvement maximum en heures
8
Pompe de prélèvement
- Pompe à débit de 1 à 3 L/min
Compléments
L’absence d’interférents peut être vérifiée en analysant quelques filtres après imprégnation.
Les deux filtres imprégnés de 500 µL de Na2CO3 à 5% peuvent éventuellement être remplacés par un seul filtre imprégné de 500 µL de Na2CO3 à 10%. Dans ce cas, la solution de désorption est plus basique et il est plus difficile de mettre en évidence un éventuel claquage.
Utilisation de la cassette fermée pour le prélèvement d’aérosols
Méthode d'analyse
Principe général de l'analyse en laboratoire
Préparation d'analyse
-
Conditions de conservation avant analyse
Les espèces prélevées et celles formées sur le filtre imprégné sont stables indéfiniment.
Remarque : En cas de prélèvement de brouillards il est prudent d'attendre quelques jours pour que la totalité des gaz dissous soit transférée vers les filtres imprégnés. Cette précaution peut s'avérer utile également si des gaz sont adsorbés sur des particules avec lesquelles ils ne réagissent pas.
-
Séparation des plages
oui -
Nombre d'étapes de préparation
3 -
Commentaires sur les étapes
La première étape décrit la désorption des supports de collecte.
Les désorbats des filtres imprégnés nécessitent un traitement particulier.
Deux traitements sont possible :
- soit le traitement sur résine H+
- soit l'ajout d'acide trifluoroacétique.
La deuxième étape décrit donc le traitement des solutions de désorption sur résine H+.
La troisième étape décrit le traitement à l'acide trifluoroacétique.
3 étapes de préparation :
Étape de préparation N°1
-
Séparation des plages
oui -
Solvant ou solution
- EAU
- ELUANT
-
Type de préparation
Désorption -
Volume
10 mL -
Ultrasons
- Temps d'ultrasons : 5 min
-
Autres conditions de préparation
- Ouvrir la cassette en veillant à ne pas perdre de particules éventuellement déposées sur parois qui précèdent le préfiltre et à ne pas polluer les filtres imprégnés
- Déposer séparément chaque filtre utilisé pour le prélèvement, les blancs de laboratoire et de terrain sur le fond de béchers ou de flacons (voir schéma dans la partie Commentaires ci dessous).
- Introduire 5 à 20 mL de solution adaptée (eau ou éluant) sur chaque filtre.
- Lors de l’analyse de la fraction particulaire effectuer un rinçage de la partie supérieure de la cassette avec un volume connu du solvant de désorption (en général 5 à 10 mL) pour récupérer les particules éventuellement présentes sur les parois.
- Soumettre les flacons aux ultrasons pendant 5 à 10 minutes (ou agitation mécanique pendant 30 minutes).
Remarque : Traiter les blancs de laboratoire et les blancs de terrain de la même façon.
-
Commentaires
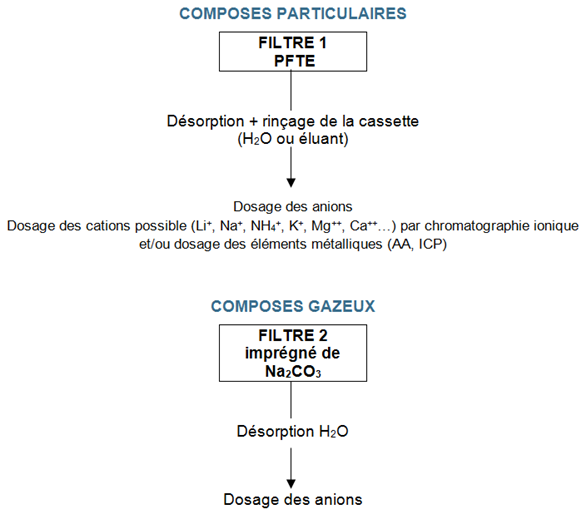
Remarque : La méthode ne permet pas de distinguer les acides sulfurique et phosphorique de leurs sels.
Étape de préparation N°2
-
Solvant ou solution
- EAU
-
Type de préparation
Percolation -
Volume
5 mL -
Autres conditions de préparation
Traitement sur résine H+
Première méthode
- Préparation de la résine H+
Juste avant l’analyse :
- préparer le montage n° 1 ou utiliser le dispositif d’extraction liquide/solide vendu dans le commerce,
- placer une ou de(s) cartouche(s) vide(s) munie(s) d’un fritté sur le dispositif,
- relier le dispositif à la trompe à eau,
- mettre en place la trompe à eau de façon à créer un vide modéré (5 à 7 cm Hg),
- rincer chaque cartouche avec de l’eau,
- verser dans chaque cartouche, au moyen d’une pipette automatique, 1,5 mL d’une solution aqueuse de résine échangeuse de cations soit environ 500 mg de résine,
- mettre en place un fritté, préalablement rincé avec de l’eau, à la partie supérieure de la cartouche ; tasser avec un agitateur en verre,
- placer sur la cartouche un adaptateur et une cartouche vide de 15 mL,
- rincer avec un grand volume d’eau (50 mL par exemple),
- sécher la résine après le dernier rinçage en appliquant un vide plus poussé.
La cartouche est prête à l’emploi.
montage 1
Préparation de la cartouche de résine H+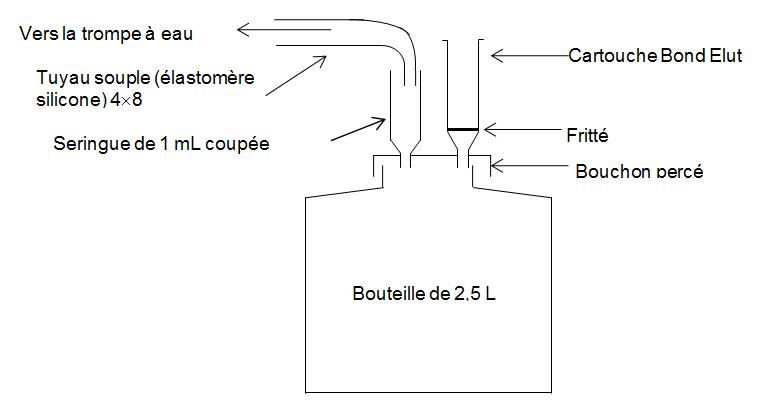
- Traitement de l’échantillon
Juste avant l’analyse :
- préparer le montage n° 2 ou un dispositif équivalent,
- prélever 5 mL de désorbat,
- le faire passer sur la résine goutte à goutte en réglant le débit de la trompe à eau,
- recueillir la solution à analyser dans un tube du passeur d’échantillon.
montage 2
Traitement des échantillons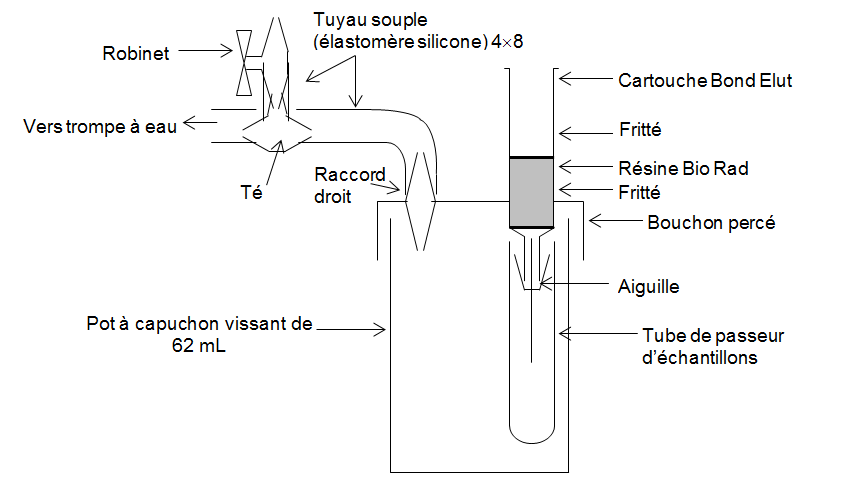
Deuxième méthode
- Lavage préalable de la résine :
- faire passer 2 L d’eau sur environ 10 g de résine placés sur un système de filtration sur fritté avec filtre de cellulose,
- sécher sous vide.
- Préparation de la suspension aqueuse de résine :
- la suspension est préparée avec un mélange 50/50 en masse d’eau et de résine fraîchement lavée,
- la suspension est maintenue en agitation par un barreau aimanté et prélevée à l’aide d’une micropipette à embout jetable.
- Traitement des désorbats des filtres imprégnés :
- prélever 2,5 mL de désorbat (décanté 1 à 2 heures afin d’éviter l’entraînement de particules solides),
- ajouter 1 mL de suspension de résine H+ dans l’eau.
Ce traitement correspond à un ajout de 0,5 mL d’eau (dont on tiendra compte soit en appliquant dans les calculs un facteur de dilution, soit en faisant subir le même traitement aux solutions d’étalonnage).
Étape de préparation N°3
-
Séparation des plages
oui -
Solvant ou solution
- ACIDE TRIFLUOROACETIQUE
-
Type de préparation
Concentration -
Autres conditions de préparation
Traitement à l’acide trifluoroacétique
- Mesurer le pH de la solution de désorption des filtres servant de blancs de laboratoire à l’aide d’une électrode combinée
de pH. - Compter le nombre de gouttes d’acide trifluoroacétique nécessaires pour ramener le pH entre 7 et 8.
- Ajouter ce même nombre de gouttes d’acide aux désorbats de filtres prélevés, aux blancs de terrain et de laboratoire et aux solutions d’étalonnage.
- Mesurer le pH de la solution de désorption des filtres servant de blancs de laboratoire à l’aide d’une électrode combinée
-
Commentaires
Se souvenir qu’au contact de l’eau l’acide trifluoroacétique forme de l’acide fluorhydrique. Lors de son utilisation prendre toutes les précautions décrites pour la manipulation d’acide fluorhydrique qui présente un danger spécifique important. En particulier, s’assurer de la présence à proximité de l’opérateur de gel au gluconate de calcium. En cas de contact accidentel, effectuer un rinçage abondant à l’eau et traiter immédiatement la peau avec du gel au gluconate de calcium avant l’apparition de la douleur.
Commentaires, conseils, conditions particulières
Préparation de l’électrolyte
Solution mère de chromate à 0,1 M
- Dans une fiole jaugée de 100 mL, placer 50 mL d’eau et 2,34 g de chromate de sodium tétrahydraté.
- Jauger et agiter énergiquement.
- Cette solution mère peut être conservée pendant un an dans un récipient en verre hermétiquement fermé.
Electrolyte de travail
- Dans une fiole jaugée de 200 mL :
- verser 9,2 mL de solution mère de chromate,
- ajouter 5 mL de modificateur de flux électroosmotique,
- ajouter environ 100 mL d’eau,
- verser, en agitant la fiole, 2 mL d’acide borique à 40 g/L préalablement préparé (passer aux ultrasons pour bien solubiliser),
- compléter à 200 mL avec de l’eau (le pH obtenu est de 8),
- dégazer sous vide.
- Cet électrolyte peut être utilisé pendant plusieurs jours s’il est conservé dans un flacon bouché.
Une condition analytique :
Condition analytique N°1
-
Technique analytique
- ELECTROPHORESE CAPILLAIRE
-
Injecteur
- PASSEUR AUTOMATIQUE
-
Colonne
- SPECIFIQUE
-
Détecteur
- ULTRAVIOLET (UV)
Étalonnage et expression des résultats
La méthode d'étalonnage indiquée est celle utilisée lors du développement. Elle n'a cependant pas de caractère obligatoire
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- Même solvant que celui des échantillons
-
Commentaires
Réaliser des étalons à partir de substances de référence, commerciales ou synthétisées en laboratoire. Le solvant utilisé pour réaliser les solutions sera celui choisi pour le traitement des échantillons.
Préparer une gamme d'étalonnage, dans la même matrice que les échantillons (ne pas oublier le filtre imprégné)
-
Calcul de la quantité de substance sur le dispositif
La concentration réelle C (en mg/m3) dans l’air est donnée par :
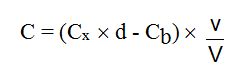
avec :
Cx (mg/L) : concentration de la substance dans l'échantillon
d : facteur de dilution
Cb ( mg/L) : concentration moyenne de la substance dans les blancs de laboratoire
v (mL) : volume de jaugeage
V (L) : volume d’air prélevé
Compléments
Des exemples de conditions d'analyse en fonction des colonnes sont données dans les "données de validation - compléments".
Remarque
Un ion de référence (par exemple 100 µL d’une solution de molybdate à 1 g/L) pourra être ajouté à chacune des solutions analysées (standards + blancs de laboratoire et blancs de terrain + échantillons inconnus). Ce pic de référence sert à corriger une éventuelle dérive des temps de rétention des ions.
Les quantités obtenues sont données en anions.
Note : La concentration dans l'air de l'acide correspondant à l'anion analysé est obtenue en multipliant la concentration en anion par un facteur (f) approprié.
Rappel :
- Les composés particulaires (sels et brouillards d'acide non volatils) sont dosés sur le préfiltre.
- Les brouillards des acides volatils (phase gazeuse et particulaire) sont dosés sur les filtres imprégnés.
| Anion | Acide | Facteur de conversion (f) |
| F - | HF | 1,053 |
| Cl - | HCl | 1,028 |
| Br - | HBr | 1,013 |
| NO2 - | HNO2 | 1,022 |
| NO3 - | HNO3 | 1,016 |
| SO4 2- | H2SO4 | 1,021 |
| PO4 3- | H3PO4 | 1,032 |
Bibliographie
- NF ISO 21438 (indice de classement AFNOR NF X 43-211). Air des lieux de travail. Détermination des acides inorganiques par chromatographie ionique. Partie 1: Acides non volatils (acide sulfurique et acide phosphorique), 2008; Partie 2 : acides volatils, sauf acide fluorhydrique (acide chlorhydrique, acide bromhydrique et acide nitrique), 2010; Partie 3 : Acide fluorhydrique et fluorures particulaires, novembre 2010.
- V. LAMANT - B. OURY - Méthodes de prélèvement et d’analyse des aérosols d’acides, de bases et des sels. NS 75, Paris, INRS, Janvier 1990.
- M. HÉRY, V. LAMANT, B. OURY, A. PELTIER - Méthodes de prélèvements d'aérosols d'acides, de bases et de sels. Cahiers de notes documentaires, 1987, 129, ND 1650, pp. 553-563.
- A. PELTIER, V. LAMANT - Prélèvement et dosage du fluor et de ses composés minéraux. NS 47, Paris, INRS, Avril 1984.
- M. HÉRY, F. DIÉBOLD, G. HUBERT, B. OURY - Fabrication de l'acide phosphorique et des engrais phosphatés et composés. Exposition aux composés fluorés et acides minéraux. Cahiers de notes documentaires, 1990, 141, ND 1803, pp. 809-816.
- M. HÉRY, G. HECHT, J.M. GERBER, M. DOROTTE, J. REFUFFAUD, A. BOULET, J.C. LIMASSET - Fabrication du dioxyde de titane par le procédé sulfurique. Évaluation des expositions chimiques. Cahiers de notes documentaires, 1991, 145, ND 1855, pp. 693-698.
- B.O. HALLBERG, J. RUDLING, A. HULTMAN, M. HULTENGREN - A filter method for the active and passive monitoring of sulfur dioxide in workplace air. Scand. J. Work Environ. Health, 10, 1984, pp. 305-309.
- A. PELTIER - Utilisation de l'acide fluorhydrique dans les laboratoires de chimie. Cahiers de notes documentaires, 2000, 178, ND 2122, pp. 37-41.
- BREUER D., HOWE A. – Performance of methods for measurement of exposure to inorganic acids in workplace air. Journal of Environmental Monitoring, 2006, 8, 120–126.
- DEMANGE M., OURY V., ROUSSET D. - Evaluation of sampling methods for measuring exposure to volatile inorganic acids in workplace air. Part 2: Sampling capacity and breakthrough tests for sodium carbonate-impregnated filters. Journal of Occupational and Environmental Hygiene, 2011, 8, 11, 642-651.
- HOWE A., MUSGROVE D., BREUER D., GUSBETH K., Moritz A., DEMANGE M., OURY V., ROUSSET D., DOROTTE M. - Evaluation of sampling methods for measuring exposure to volatile inorganic acids in workplace air. Part 1: sampling hydrochloric acid (HCl) and nitric acid (HNO3) from a test gas atmosphere. Journal of Occupational and Environmental Hygiene, 2011, 8, 8, 492-502.
Historique
| Version | Date | Modification(s) faisant l’objet | Paragraphes |
|---|---|---|---|
| 009 | Jusqu’au | Création et mises à jour |
|
| 009/V01.01 | 31/05/2010 | Création de l’historique |
|
|
|
| Nouvelle présentation | Partout |
|
|
| Précisions sur le principe du prélèvement | Principe |
|
|
| Précisions sur le risque d’interférences | Interférences |
|
|
| - Annulation de la possibilité d’utiliser des membranes PVC-acrylonitrile (DM800) comme préfiltre sauf en cas de prélèvement de fluorures insolubles (risque de sous-estimation des très faibles quantités d’HNO3). et permettre de mettre en évidence d’éventuels phénomènes de claquage | Matériel de prélèvement |
|
|
| Bibliographie complétée et révisions éditoriales diverses | Partout |
|
|
| - Suppression de la possibilité d’utiliser des préfiltres en PTFE s’il y a fusion (fluorures insolubles) | Annexe 1 |
|
|
| - Précisions sur le domaine d’application de cette annexe | Annexe 7 |
|
|
| - Combinaison des annexes 10 et 11 | Annexe 10 |
| 009/V01.02 | 23/07/2010 | Porosité du filtre PTFE | Prélèvement et Matériel de prélèvement |
|
|
| Affichage des données de validation | Annexe 10 |
| 009/V01.03 | 2013 | Révision de la terminologie | Toute la fiche |
| M-144/V01 | Novembre 2015 | Mise en ligne Prélèvement sur cassette fermée Tous les anions minéraux Analyse par électrophorèse capillaire | |
| M-144/V01.1 | Septembre 2016 | Correction porosité membrane | |
| M-144/V01.2 | Mai 2017 | Précisions pour redéfinir les brouillards d'acides volatils et d'acides non volatils | Principe et informations Technique de préparation d'analyse N°1 Etalonnage et expression des résultats |
Date de mise à jour : mai 2017
Ancien numéro de fiche MétroPol : 009
